La atrofia muscular es una de las complicaciones comunes en pacientes con hemodiálisis de mantenimiento (HDM) y tiene un mal pronóstico. Nuestro objetivo es estudiar la eficacia y fiabilidad de la ecografía en la evaluación de la sarcopenia en pacientes con HDM.
MétodoLos pacientes con HDM se dividieron en los grupos de sarcopenia y sin sarcopenia, de acuerdo con los criterios diagnósticos del Grupo de Trabajo de Asia sobre Sarcopenia (GTAS) 2019. Se realizó una ecografía de la cabeza medial izquierda del músculo gastrocnemio en pacientes con HDM y un grupo de control saludable para obtener los parámetros de grosor muscular (GM), ángulo de pluma (AP), longitud del haz (LH), área transversal (AT), intensidad de eco (IE), módulo de elasticidad (ME), velocidad de onda de corte (VOC) y velocidad microvascular (VM). Se compararon las diferencias en los parámetros de ultrasonido entre los diferentes grupos y se determinó el valor crítico adecuado para el diagnóstico de sarcopenia en pacientes con HDM.
ResultadosLos niveles de GM, AT, AP y VM en el grupo con sarcopenia fueron menores que en el grupo sin sarcopenia y el grupo de control; mientras que la IE fue mayor, la LH en el grupo con sarcopenia fue menor que en el grupo sin sarcopenia, y el ME y la VOC en el grupo con sarcopenia fueron mayores que en el grupo control. El análisis de la curva característica de trabajo del sujeto mostró que el índice combinado de ultrasonido tenía un buen valor diagnóstico, con el modelo Y=13,511-0,121*GM-0,609*AT-0,172*AP+0,011*IE-2,205*VM (p<0,05), con un valor de corte de 0,69.
ConclusiónLa ecografía multimodal es un método de examen por imágenes seguro, no invasivo e instantáneo que puede proporcionar información sobre la estructura, rigidez y perfusión muscular, y se espera que se convierta en una herramienta con potencial y prometedora para predecir la sarcopenia en pacientes con HDM.
Sarcopenia is one of the common complications in maintenance hemodialysis (MHD) patients and is associated with poor prognosis. We aimed to study the validity and reliability of ultrasound in the assessment of sarcopenia in MHD patients.
MethodsMHD patients were categorized into the sarcopenia group and the non-sarcopenia group according to the diagnostic criteria of the Asian Working Group on Sarcopenia (AWGS) 2019. Ultrasonography of the left medial head of the gastrocnemius muscle was performed in MHD and healthy controls to obtain muscle thickness (MT), pinnation angle (PA), fascicle length (FL), cross-sectional area (CSA), echo intensity (EI), elastic modulus (E), shear wave velocity (SWV), and microvascular velocity (MV). Compare the differences in ultrasound parameters among different groups, and determine the cut-off values suitable for diagnosing sarcopenia in MHD patients.
ResultsThe MT, CSA, PA, and MV in the sarcopenia group were lower than those in the non-sarcopenia group and the control group; while the EI was higher, the FL of the sarcopenia group was lower than that of the non-sarcopenia group, while the E and SWV of the sarcopenia group were higher than those of the control group. Receiver operating characteristic curve analyses indicated that ultrasound combined index had a good diagnostic value, model Y=13.511-0.121*MT-0.609*CSA-0.172*PA+0.011*EI-2.205*MV (p<0.05), with a cut-off value of 0.69.
ConclusionsMulti-modal ultrasound is a safe, non-invasive, and real-time imaging examination method, and can provide information on muscle structure, stiffness, and perfusion, which is expected to be a promising potential tool for predicting sarcopenia in MHD patients.
La sarcopenia es una enfermedad progresiva de la musculatura esquelética sistémica relacionada con la edad que cursa con pérdida generalizada de masa y fuerza musculares y disminución del rendimiento físico1. La hemodiálisis de mantenimiento (HDM) es el tratamiento sustitutivo más frecuente de la nefropatía terminal (NT) y determinados factores adversos, como pérdida o captación insuficiente de nutrientes durante la diálisis prolongada, desequilibrios hormonales, trastornos electrolíticos e inflamación crónica, pueden acelerar el proceso de agotamiento proteico-energético, lo que incrementa la pérdida muscular y grasa y entraña un riesgo elevado de sarcopenia2,3. La prevalencia de sarcopenia en los pacientes con HDM varía debido a diferencias en la raza, el tamaño de la muestra y los criterios diagnósticos. La sarcopenia aumenta significativamente la incidencia de episodios adversos, como caídas, fracturas, episodios cardiovasculares y mortalidad global4,5. Por consiguiente, la identificación precoz de los pacientes con riesgo de sarcopenia y la aplicación de intervenciones tienen una gran trascendencia clínica y son importantes para prolongar la vida de los pacientes sometidos a diálisis y mejorar su calidad de vida.
La medición de la masa muscular es un paso importante en el diagnóstico de la sarcopenia. Para determinar la masa muscular se dispone clínicamente de análisis de impedancia bioeléctrica (BIA), absorciometría radiológica de doble energía (DEXA), TC, RM y ecografía6. Sin embargo, la exactitud del BIA y la DEXA puede verse influida por el estado de hidratación y la adiposidad del paciente7,8. La RM es más cara y adolece de ciertas limitaciones, como contraindicación en caso de implantes metálicos y falta de criterios diagnósticos. Aunque se considera que la TC es el método de referencia para medir la masa muscular, no resulta adecuada para un cribado generalizado de la sarcopenia debido a la exposición a radiación y a su elevado coste9,10. En consecuencia, se considera especialmente importante encontrar un instrumento de evaluación validado y adecuado para uso clínico. La ecografía, como método de imagen no invasivo, puede utilizarse para evaluar la estructura, rigidez y perfusión microvascular musculares mediante ecografía bidimensional en escala de grises, elastografía e imagen microvascular de alta definición, que tiene las ventajas de su uso a la cabecera del paciente y de forma instantánea, cómoda y fácil. Se ha descrito el uso de ecografía para medir el grosor muscular, el área transversal, el ángulo de pluma y la longitud del haz con el fin de determinar la masa muscular11,12. En la actualidad, rara vez se aplica ecografía en pacientes con sarcopenia por HDM. Por consiguiente, en este estudio se investigó la utilidad de la ecografía multimodal para diagnosticar la sarcopenia en pacientes sometidos a HDM con el fin de identificar precozmente a aquellos con riesgo de sarcopenia y de mejorar su pronóstico y calidad de vida.
Materiales y métodosParticipantesComo población del estudio se seleccionó a 52 pacientes que recibieron HDM en la consulta externa del Servicio de Nefrología del Segundo Hospital Afiliado de la Universidad Médica de Chongqing entre marzo de 2022 y octubre de 2022. Los criterios de inclusión fueron: (1) tiempo de hemodiálisis regular ≥3 meses; (2) edad ≥18 años, conocimiento del estudio y participación voluntaria. Los criterios de exclusión fueron: (1) embarazo, pacientes con enfermedad mental, pacientes con deterioro cognitivo; (2) incapacidad de tolerar el BIA o las pruebas de fuerza de prensión o velocidad de la marcha por motivos físicos; (3) enfermedades causantes de emaciación, como neoplasias malignas, tuberculosis, hepatopatía o úlcera péptica; (4) paratiroidectomía previa; (5) infección aguda o accidente cardiovascular en los 6 meses previos; (6) miopatías primarias, como miastenia grave. Se seleccionó al azar a 24 examinandos sanos como grupo de control y el criterio de rechazo fue: obtención insatisfactoria de imágenes. Se incluyó a un total de 46 pacientes con HDM y 23 examinandos sanos conforme a los criterios de inclusión, exclusión y rechazo. El comité ético de investigación clínica del Segundo Hospital Afiliado de la Universidad Médica de Chongqing aprobó este estudio (n.° 2023-9). Todos los pacientes firmaron un consentimiento informado.
Fuerza muscularLa fuerza de prensión se evaluó con un medidor electrónico de dicha fuerza (CAMRY EH101, China). Se coloca al paciente en bipedestación, con ambas extremidades superiores colgando de forma natural a los lados. Ambas manos se miden dos veces, con un intervalo de 3 minutos entre cada medición, y se toma el valor máximo.
Prueba de marcha de 6 metrosSe seleccionó una evaluación de la velocidad de la marcha durante 6 metros. Los pacientes caminaron 6 metros en línea recta a velocidad normal, sin instrumentos de ayuda ni disminuir la velocidad, se registró el tiempo necesario y se repitió la medición después de 3 minutos de reposo, obteniéndose el promedio de las dos mediciones.
Estimación de la masa muscularSe utilizó un analizador de impedancia bioeléctrica (InBody s10, China) para medir la composición corporal al finalizar la diálisis. Las mediciones fueron: índice de masa corporal (IMC) y masa muscular esquelética (MME) (índice de masa muscular esquelética apendicular, IMEA) (kg/m2)=MME (kg)/estatura al cuadrado (m2).
Criterios diagnósticos de desnutriciónSe evaluó el estado nutricional de los pacientes con HDM mediante la escala PG-SGA (Evaluación global subjetiva generada por el paciente). Una puntuación final ≤1 indica un buen estado nutricional, mientras que una puntuación >1 indica que el paciente puede tener desnutrición.
Medición de parámetros ecográficosSe utilizó un ecógrafo Doppler en color Aixpiorer (Francia) para medir los parámetros de estructura muscular en la cabeza medial del músculo gastrocnemio izquierdo y se seleccionó la sonda SL-15 a una frecuencia de 15MHz. Se colocó a los pacientes en decúbito prono sobre la camilla de exploración y se les pidió que se relajaran durante 10 minutos con la extremidad inferior izquierda expuesta, manteniendo el pie izquierdo hacia abajo de forma natural y el tobillo izquierdo en posición neutra. La sonda se aplicó sobre la piel con una carga mínima para garantizar que la presión externa no pudiera afectar a las pruebas. Se seleccionó el modo panorámico bidimensional musculoesquelético y se obtuvo la vista transversal de la cabeza medial del músculo gastrocnemio izquierdo en el tercio medio superior de la línea, desde el cóndilo tibial medial hasta el punto más alto del maléolo medial. Se visualizaron claramente las estructuras musculares y se midió el área transversal (AT). Las imágenes transversales bidimensionales se importaron a Adobe Photoshop 20 y se midió la intensidad de eco (IE); a continuación, se rotó la sonda 90 grados para obtener la imagen longitudinal en la misma posición y se midió el grosor muscular (GM), el ángulo de pluma (AP) y la longitud del haz (LH) del músculo; en el modo de imagen de microflujo, se seleccionó la escala de velocidad como 2cm/s y se midió la velocidad microvascular (VM) con onda pulsada; en el modo SWE (elastografía por onda de cizallamiento), el tamaño de la región de interés se fijó en mm. La Q-Box se fijó en 5×5mm y se midieron la velocidad de onda de corte (VOC) y el módulo de elasticidad (ME) a una distancia de 1,0-1,5cm de la piel. El mismo ecografista obtuvo los parámetros de todos los sujetos. Los parámetros anteriores se midieron 3 veces consecutivas y se tomó el valor promedio.
Criterios diagnósticos de sarcopeniaEl diagnóstico de sarcopenia se basó en los criterios del Grupo de Trabajo de Asia sobre Sarcopenia (GTAS), con los siguientes valores de corte: (1) masa muscular baja: IMEA medido mediante BIA<7,0kg/m2 en los varones y <5,7kg/m2 en las mujeres; (2) fuerza muscular baja: fuerza de prensión <28kg en los varones y <18kg en las mujeres; (3) movilidad física: el valor de corte de una velocidad de la marcha baja fue <1,0m/s. En este estudio, los pacientes que cumplieron los criterios (1) y (2), con o sin cumplir el (3), fueron incluidos en el grupo con sarcopenia.
Análisis estadísticosLos análisis estadísticos se realizaron con el programa SPSS 26.0 (SPSS Inc., IBM Corporation, Armonk, NY, Estados Unidos). Las variables categóricas se expresaron en forma de recuentos y porcentajes (n, %) y se compararon entre los grupos mediante la prueba de la ji al cuadrado. Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de los datos de las mediciones; las variables de distribución normal se expresaron en forma de media±DE y las de distribución no normal, en forma de P50. Los grupos múltiples se compararon con un ANOVA unidireccional. Se realizó un análisis de regresión logística binaria para determinar los factores que podrían influir en la sarcopenia en pacientes con HDM. Se utilizó un análisis del coeficiente de correlación de Pearson para comparar la relación entre parámetros ecográficos y datos clínicos. Se emplearon curvas de eficiencia diagnóstica (ROC, receiver operating characteristic) y el área bajo la curva con el fin de evaluar el valor diagnóstico de la ecografía para detectar sarcopenia. El mejor valor de corte se calculó mediante el índice de Youden. Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosInformación generalEn este estudio se incluyó un total de 46 pacientes con HDM y 23 controles sanos emparejados por la edad. De los 46 pacientes con HDM, 22 (47,83%) fueron incluidos en el grupo con sarcopenia y 24 (52,17%) en el grupo sin sarcopenia. Al comparar las condiciones generales de los 3 grupos de pacientes, se observaron diferencias estadísticamente significativas en cuanto a sexo, IMC, hipertensión, desnutrición, albúmina y PCR (p<0,05), pero no hubo diferencias estadísticas en cuanto a edad y diabetes (tabla 1).
Comparación de la información general entre los grupos con sarcopenia, sin sarcopenia y de control
| Características | Con sarcopenia (n=22) | Sin sarcopenia (n=24) | Control (n=23) | p |
|---|---|---|---|---|
| Edad, años | 62,96±16,33 | 54,79±12,96 | 60,3±7,14 | 0,065 |
| Mujeres, n (%) | 9 (40,9) | 8 (33,3) | 17 (70,8) | 0,033 |
| Duración de la diálisis, años | 5 (3,8,5) | 6 (2,9) | - | 0,982 |
| Índice de masa corporal, kg/m2 | 20,26±3,48 | 23,38±3,02 | 22,73±2,69 | 0,003 |
| Nefropatías primarias, n (%) | ||||
| Hipertensión arterial | 18 (81,8) | 24 (100) | 7 (29,1) | <0,001 |
| Diabetes | 6 (27,2) | 5 (20,8) | 3 (12,5) | 0,493 |
| Desnutrición | 18 (81,8) | 5 (20,8) | 0 (0) | <0,001 |
| Albúmina | 38,57±4,67 | 41,70±3,48 | - | 0,012 |
| PCR (+), n (%) | 9 (40,9) | 3 (12,5) | - | 0,028 |
PCR (+): PCR≥10mg/l.
La sarcopenia se asoció a varios factores y los indicadores que fueron significativos en el análisis de regresión unifactorial (p<0,05) se incluyeron en el análisis de regresión logística binaria. Los resultados revelaron que la desnutrición (OR=0,028, IC del 95%: 0,005-0,139, p<0,001) y el IMC (OR=0,713, IC del 95%: 0,550-0,925, p<0,05) se asociaron a sarcopenia en pacientes con HDM (tabla 2).
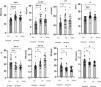
Parámetros ecográficosEn la figura 1 se muestran los parámetros estructurales de la cabeza medial del músculo gastrocnemio izquierdo medidos mediante ecografía en estado relajado en cada grupo. En comparación con el grupo sin sarcopenia, los valores de GM, AT, LH, AP y VM fueron menores en el grupo con sarcopenia, mientras que la IE fue mayor. No hubo diferencias estadísticamente significativas en cuanto a ME y VOC; en comparación con el grupo de control, los valores de GM, AT, AP y VM fueron menores en el grupo con sarcopenia, mientras que los de IE, ME y VOC fueron mayores, al tiempo que las diferencias en el LF no fueron estadísticamente significativas; en comparación con el grupo de control, la VM del grupo sin sarcopenia fue menor que la del grupo de control y no hubo diferencias estadísticamente significativas entre los dos grupos en otros parámetros estructurales musculares.
Los resultados anteriores indican que GM, AT, AP, IE y VM se correlacionaron con sarcopenia; se utilizaron curvas ROC para investigar si dichas variables podrían actuar como marcadores diagnósticos para identificar sarcopenia en pacientes con HDM. Según el análisis de las curvas ROC, el área bajo la curva de los índices ecográficos combinados es de 0,902, mayor que el de cualquier variable independiente (fig. 2). El mejor valor de corte de los índices ecográficos combinados para el diagnóstico de sarcopenia fue de 0,69, con una sensibilidad del 77,3% y una especificidad del 91,7%, modelo Y=13,511-0,121*GM-0,609*AT-0,172*AP+0,011*IE-2,205*VM (p<0,05).
Según se aprecia en la figura 3, existe una cierta correlación entre los indicadores ecográficos combinados y los parámetros diagnósticos clínicos de sarcopenia, con una correlación negativa moderada entre el IMEA, la fuerza de prensión y la velocidad de la marcha (p<0,001). A fin de excluir la influencia de factores relacionados con la sarcopenia en los resultados de las mediciones, se hicieron ajustes respecto al IMC y el estado nutricional y, a tenor de los resultados, los indicadores ecográficos combinados siguieron teniendo cierta correlación con el IMEA, la fuerza de prensión y la velocidad de la marcha.
Análisis de correlación entre los índices ecográficos combinados y los parámetros diagnósticos clínicos de sarcopenia. A: Correlaciones entre el IMEA y los índices ecográficos combinados. B: Correlaciones entre la velocidad de la marcha y los índices ecográficos combinados. C: Correlaciones entre la fuerza muscular y los índices ecográficos combinados.
Con la mejora del nivel de vida y la tendencia al envejecimiento de la población, la incidencia de nefropatía crónica va aumentando anualmente. Según las estadísticas, la prevalencia de nefropatía crónica (NC) en China es del 8,2%, representando los pacientes con NC en estadio 4-5 en torno al 1,8%13. La HDM es un tratamiento importante y mejora la tasa de supervivencia de los pacientes con NC terminal. Por desgracia, el tratamiento de HDM también se asocia a una serie de complicaciones, como sarcopenia. Según un estudio sobre la prevalencia de sarcopenia en pacientes con HDM realizado en China, dicha prevalencia rondó el 13,7%, mientras que la incidencia de sarcopenia en los pacientes con HDM mayores de 60 años ascendió al 33,3%14. Cada vez hay más datos que indican que la sarcopenia se asocia a un incremento de las rehospitalizaciones y la mortalidad en los pacientes con HDM. En la actualidad, la ecografía de alta frecuencia puede mostrar claramente la estructura muscular debido a las diferentes impedancias acústicas de músculos, tendones y otros tejidos conjuntivos. Con el desarrollo de las técnicas de elastografía por ondas de cizallamiento y obtención de imágenes con ultramicrohaz, la ecografía también puede evaluar la rigidez muscular y la perfusión de microhaces, lo que permite una evaluación más exhaustiva de la masa muscular. Los estudios han puesto de manifiesto que la ecografía muestra una buena concordancia con la RM de referencia en la evaluación de la masa muscular15. Aunque, según algunos estudios, la ecografía puede utilizarse para diagnosticar la sarcopenia16, hay pocos datos sobre su capacidad diagnóstica en pacientes con HDM y sarcopenia.
La reducción de la masa muscular provocada por la HDM es heterogénea y más pronunciada en los músculos que soportan el peso de las extremidades inferiores, como el cuádriceps y el gastrocnemio. El gastrocnemio, como músculo fijado en un solo punto con disposición paralela de las fibras musculares, constituye el lugar ideal para evaluar el AP, la LH y el GM17. Aunque en estudios anteriores se ha comprobado que el GM, el AT muscular y la rigidez muscular son buenos factores predictivos de sarcopenia en la población geriátrica, no está clara la relación entre estos índices ecográficos y la sarcopenia en los pacientes con HDM. En este estudio se evaluó la cabeza medial del músculo gastrocnemio izquierdo y se comparó con parámetros antropométricos de uso habitual para predecir la sarcopenia en pacientes con HDM. Según los resultados de Wang et al., el GM medido mediante ecografía puede considerarse directamente un factor de masa muscular baja18. Kuyumcu et al. determinaron un valor de corte del grosor de la cabeza medial del músculo gastrocnemio para diagnosticar sarcopenia de 16,9mm19. Nuestro estudio indicó que podría utilizarse un valor crítico de grosor de la cabeza medial del músculo gastrocnemio izquierdo de 16,95mm para diagnosticar sarcopenia en los pacientes con HDM con una sensibilidad del 95,5%. En varios estudios se ha constatado que el AT del músculo esquelético medida mediante ecografía tiene una correlación significativamente elevada con la TC y la RM20. A tenor de nuestros resultados, el área bajo la curva prevista por el AT para identificar sarcopenia es de 0,887, lo que representa uno de los mejores indicadores predictivos de sarcopenia en los pacientes con HDM y muestra una correlación moderada con los parámetros diagnósticos clínicos de sarcopenia (IMEA, fuerza de prensión y velocidad de la marcha, r=0,718, 0,533 y 0,444, respectivamente). Algunos investigadores han señalado que las determinaciones de AP y LF son técnicas prometedoras y potencialmente eficaces para predecir la sarcopenia1,21. Sin embargo, Kuyumcu et al. constataron que el AP no se asoció significativamente a una reducción de la masa muscular, ya que la medición del AP y LF se ve afectada en gran medida por la posición del paciente, de modo que una ligera contracción muscular puede alterar significativamente la magnitud del AP y el LF, dando lugar a determinaciones inestables19. En nuestra investigación no se observaron diferencias significativas en cuanto a la LF entre los grupos con sarcopenia y de control; aunque sí hubo ciertas diferencias en cuanto al AP entre los 3 grupos, la sensibilidad y la especificidad del diagnóstico no fueron elevadas. La incongruencia de los resultados entre diferentes estudios podría estar relacionada con la estabilidad de la medición de estos dos indicadores. Por consiguiente, resulta necesario seguir investigando la utilidad del uso del AP y la LF solos para diagnosticar sarcopenia en los pacientes con HDM. Los pacientes con HDM se encuentran en un estado microinflamatorio crónico y el estado inflamatorio prolongado puede afectar directamente a la perfusión del flujo sanguíneo en el músculo esquelético. Las técnicas de imagen ultramicrofluídicas pueden mostrar claramente un flujo sanguíneo microscópico de baja velocidad con una resolución elevada. Esta técnica se emplea habitualmente en las enfermedades hepáticas y mamarias. Un estudio de revisión sistemática confirmó su utilidad en las enfermedades musculoesqueléticas22. Sin embargo, rara vez se han empleado técnicas de imagen de flujo ultramicroscópico en pacientes con sarcopenia y HDM. A tenor de los resultados de Hernández-Socorro et al., la actividad microangiógena fue significativamente menor en los pacientes con debilidad muscular o masa muscular baja que en los sujetos sanos23. Aunque en el presente estudio no se comparó la actividad microangiógena muscular entre los grupos con y sin sarcopenia, se comprobó que las velocidades del flujo sanguíneo microvascular fueron significativamente menores en los pacientes con sarcopenia que en aquellos sin sarcopenia. Esto podría deberse al daño microvascular y estancamiento de la sangre causados por la inflamación prolongada en los pacientes con HDM; los resultados de nuestra investigación también indican que la concentración de PCR se elevó significativamente en los pacientes con sarcopenia. La VM no se ve afectada por la estatura ni el peso del paciente y guarda una cierta correlación con los parámetros clínicos de IMEA, fuerza de prensión y velocidad de la marcha, por lo que cabe esperar que sea un indicador fiable para predecir la aparición de sarcopenia en los pacientes con HDM. Un estudio sobre la rigidez muscular en pacientes con sarcopenia reveló que dicha rigidez fue menor en los pacientes con sarcopenia que en aquellos sin sarcopenia tanto en estado de relajación como de contracción; la disminución de la resistencia y el aumento de la flexibilidad del sistema de fibras elásticas en la matriz extracelular de las células musculares son uno de los motivos de la disminución de la rigidez muscular en los pacientes con sarcopenia24,25. En nuestra investigación, los valores de VOC y ME fueron mayores en el grupo con sarcopenia que en el de control, pero no hubo diferencias significativas con los valores respectivos del grupo sin sarcopenia. Nuestros resultados indican que la rigidez muscular fue mayor en el grupo con sarcopenia que en el de control, lo que podría deberse a un incremento del tejido correspondiente a las fibras intersticiales del músculo esquelético (especialmente del colágeno de tipo I) en los pacientes con sarcopenia, lo que aumenta la rigidez muscular26. Además, los pacientes con HDM presentan trastornos electrolíticos y un desequilibrio calcio-fósforo y el calcio puede depositarse de forma heterotópica en el músculo, lo que conlleva un incremento de la rigidez muscular27. El aumento de la edad no sólo causa atrofia muscular, sino también infiltración grasa, lo que conlleva una disminución de la rigidez muscular. Esto tampoco deparó diferencias estadísticamente significativas en cuanto a los valores de EOC y ME entre los grupos con y sin sarcopenia. La intensidad ecogénica muscular se considera un indicador objetivo para evaluar la sarcopenia y puede indicar la presencia de inflamación, fibrosis e infiltración grasa en los músculos28. Según este estudio, la IE fue mayor en el grupo con sarcopenia que en los grupos sin sarcopenia y de control. La IE muscular no se ve afectada por la posición corporal ni por el técnico y los resultados se obtienen por medio de un programa informático específico. Los resultados son objetivos y estables y cabe esperar que sea un indicador fiable para predecir la aparición de sarcopenia en los pacientes con HDM.
Los resultados anteriores indican que la ecografía tiene una cierta utilidad para predecir la sarcopenia en los pacientes con HDM. Los indicadores individuales pueden tener limitaciones en cuanto al diagnóstico debido a la influencia de las diferentes constituciones corporales de los pacientes y las posturas en las mediciones. Los índices ecográficos combinados no sólo son superiores a los indicadores individuales en lo que respecta a eficacia diagnóstica, sino que también muestran una mejor correlación con los parámetros diagnósticos clínicos de sarcopenia (IMEA, fuerza de prensión y velocidad de la marcha), lo que los hace más adecuados como indicadores predictivos de sarcopenia en los pacientes con HDM.
En la actualidad, el uso de la ecografía es raro en el diagnóstico de la sarcopenia en pacientes con HDM y los criterios clínicos existentes para diagnosticar sarcopenia exigen la medición de la fuerza de prensión y la velocidad de la marcha, que no pueden evaluarse en pacientes con trastornos de las extremidades superiores y dificultad para ponerse de pie y caminar. La ecografía puede servir como un método de detección seguro, no invasivo, sencillo e instantáneo que sustituya a la compleja evaluación clínica de la sarcopenia.
ConclusionesEn este estudio transversal se evaluó la viabilidad clínica de la ecografía como herramienta diagnóstica en pacientes con HDM y sarcopenia. La ecografía multimodal muestra una excelente capacidad para identificar a pacientes con un mayor riesgo de sarcopenia y tiene una mejor capacidad diagnóstica, de modo que ofrece un método de evaluación cómodo, instantáneo y objetivo para el diagnóstico y seguimiento de la sarcopenia clínica.
Consideraciones éticasSe obtuvo la aprobación ética del comité de ética del Segundo Hospital Afiliado de la Universidad Médica de Chongqing.
FinanciaciónEste proyecto contó con la financiación de la Natural Science Foundation de la Municipalidad de Chongqing (China, CSTB2022NSCQMSX0766), el Chongqing Science and Health Joint Medical Research Project (China, 2024MSXM154) y el Chongqing Hospital of Traditional Chinese Medicine Fourth Young Top Talent Program (China).
Conflicto de interesesLos autores declaran que carecen de conflictos de intereses.
Declaración sobre el uso compartido de datosLos datos que respaldan los resultados de este estudio se encuentran disponibles, previa solicitud razonable, a través del autor para el envío de correspondencia.
Deseamos expresar nuestro agradecimiento a todas las familias implicadas en este estudio. Al mismo tiempo, damos las gracias a todos los participantes que ofrecieron su tiempo para participar en este estudio.