La evaluación multimodal de la congestión y el protocolo ecográfico de exceso venoso (VExUS) desempeñan un papel determinante en la evaluación del volumen y la terapia descongestiva en pacientes con insuficiencia cardíaca aguda (ICA).
MétodosEstudio prospectivo, unicéntrico y observacional en pacientes ingresados por ICA en la planta de Medicina Interna, diseñado para explorar la prevalencia, los predictores y los resultados clínicos de la congestión (puntuación VExUS) y la prevalencia de la nefropatía congestiva.
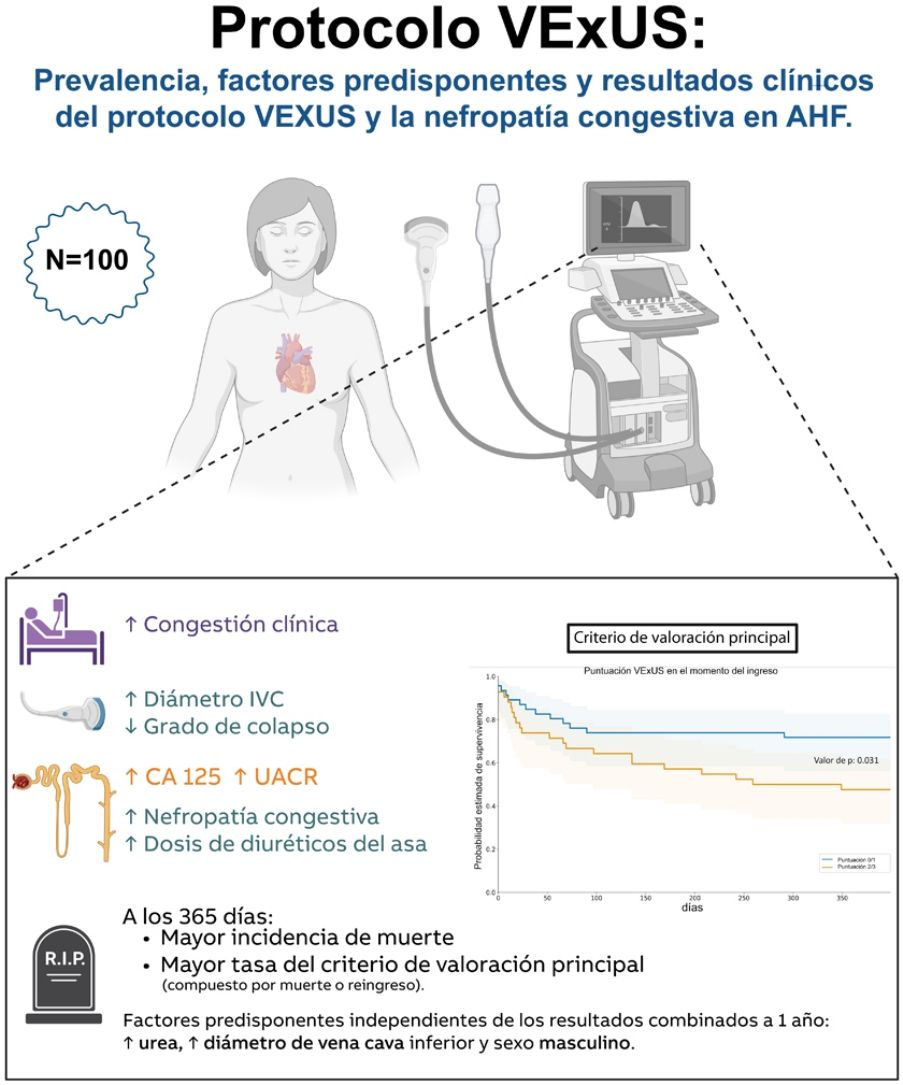
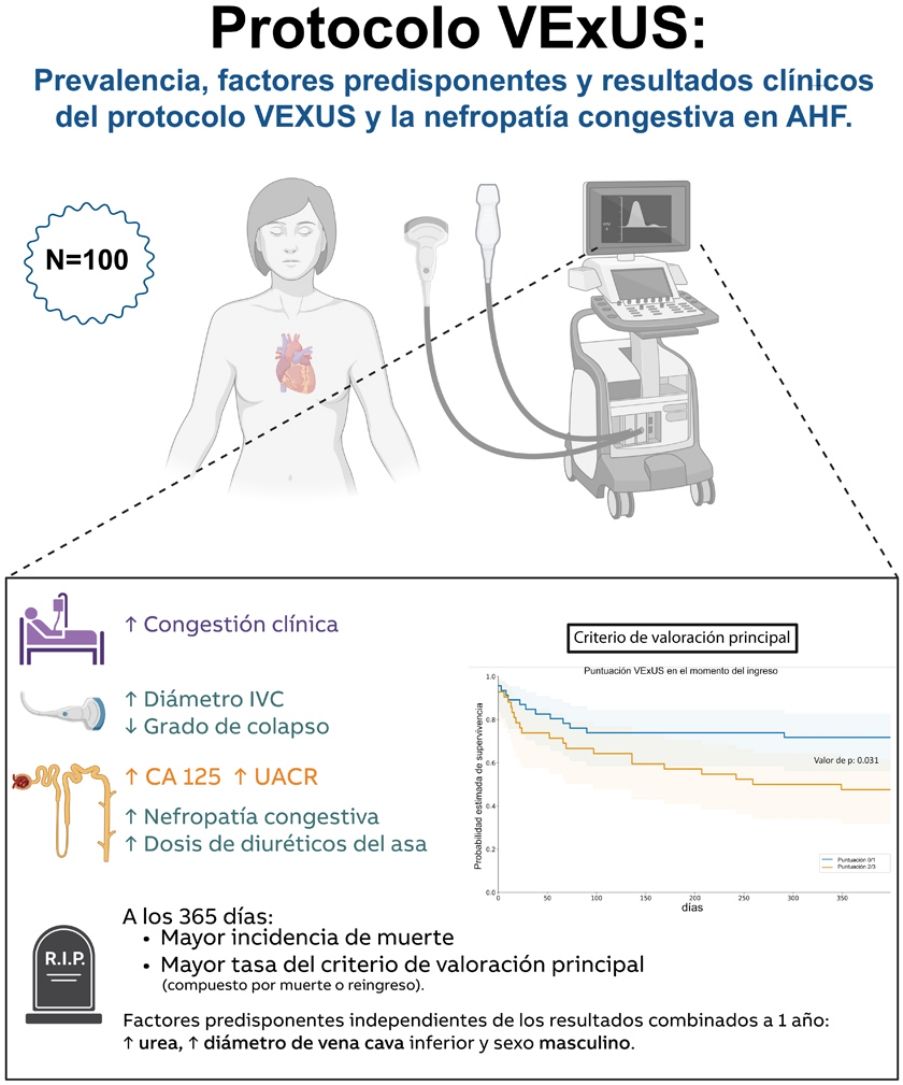
ResultadosSe incluyeron 100 pacientes (edad media de 86±8 años, 51% mujeres). Según el protocolo VExUS, el 49% presentaron congestión moderada a grave (VExUS 2-3). Estos pacientes presentaron mayor congestión clínica, mayores concentraciones de CA125 y un cociente microalbúmina/creatinina, y requirieron mayores dosis de diuréticos de asa durante la hospitalización. La prevalencia de nefropatía congestiva al ingreso fue del 38%. Los pacientes con una puntuación VExUS al ingreso ≥2 tuvieron un riesgo 2,5 veces mayor de mortalidad por cualquier causa y/o hospitalización por IC al año (OR: 2,52; IC95%: 1,02-6,26; p=0,046). En el análisis multivariable, los niveles elevados de urea, el mayor diámetro de la vena cava inferior y el sexo masculino se identificaron como predictores independientes, además de la puntuación VExUS, para la mortalidad a un año, con un área bajo la curva para el modelo final de 0,740 (p<0,001).
ConclusionesLa congestión moderada a grave (VExUS grado 2-3) se asocia con puntuaciones de congestión clínica más altas, mayor necesidad de tratamiento diurético y peores resultados clínicos, incluyendo un aumento de la mortalidad y las tasas de rehospitalización en la ICA. Además, un tercio de los casos de ICA presentaron nefropatía por congestión, una situación clínicamente relevante que puede influir en los tratamientos descongestivos y los resultados finales.
Multimodal assessment of congestion and venous excess ultrasound protocol (VExUS) play a determinant role for volume assessment and decongestive therapy in patients with acute heart failure (AHF).
MethodsProspective, unicentrical and observational study in patients admitted for AHF at the Internal Medicine ward, designed to explore the prevalence, predictors and clinical outcomes of congestion (VExUS score) and the prevalence of congestive nephropathy.
ResultsA total of 100 patients were included (mean age 86±8 years were and 51% females). According to VExUS protocol, 49% exhibited moderate to severe congestion (VExUS 2-3). These patients were more clinical congested, showed higher concentrations of CA125 and microalbumin/creatinine ratio, and need greater doses of loop diuretics during hospitalization. The prevalence of congestive nephropathy on admission was 38%. Patients with VExUS score on admission ≥2 had a 2.5-fold increased risk for all-cause mortality and/or HF hospitalization at 1year (OR 2.52, 95%CI: 1.02-6.26, P=.046). In multivariable analysis elevated urea levels, larger inferior vena cava diameter and male gender, were identified as independent predictors on top of VExUS score for one-year mortality with an area under the curve for the final model of 0.740 (P<.001).
ConclusionsModerate to severe congestion (VExUS grade 2-3) is associated with higher clinical congestion scores, greater need for diuretic treatment, and worse clinical outcomes, including increased mortality and rehospitalization rates in AHF. Furthermore, one-third of AHF showed congestion nephropathy a situation with clinical relevance that can influence decongestive treatments and final outcomes.
La insuficiencia cardíaca (IC) es la principal causa de hospitalización en Europa y en Estados Unidos1. Un tercio de los pacientes con IC son dados de alta con congestión residual, una situación relacionada con peores resultados2. La detección de la congestión vascular y tisular en los pacientes con IC es complicada, especialmente en aquellos con IC avanzada y una prevalencia elevada de enfermedades concomitantes. Por tanto, la graduación de la congestión durante el ingreso es la clave para ajustar el tratamiento diurético y evitar la congestión residual en el momento del alta3,4.
La ecografía de diagnóstico inmediato ha demostrado su utilidad en la evaluación de la congestión vascular y tisular durante los ingresos5. La vena cava inferior (VCI) y el tratamiento guiado por ecografía pulmonar en el ensayo de ICA (CAVAL US-AHF)6 proporcionan evidencia del uso de la ecografía para guiar el tratamiento y lograr la descongestión para disminuir los episodios tras el alta. Por otro lado, Beaubien-Souligny et al.7 proponen el protocolo VExUS como una herramienta valiosa para evaluar la congestión; esta herramienta ha sido validada en el síndrome cardiorrenal de tipo1 y también ha sido propuesta para instaurar el tratamiento intravenoso en presencia de nefropatía congestiva8 (NC). En este contexto, la detección de NC mediante la alteración del flujo venoso se ha descrito como un predictor independiente de hospitalizaciones por IC y muerte cardiovascular9. Sin embargo, no existe una definición universalmente consolidada10; en general, la NC se considera una forma potencialmente reversible de disfunción renal motivada por un aumento de la presión intersticial renal debido a congestión. El diagnóstico de NC requiere un abordaje integral que considere factores hemodinámicos como el flujo venoso renal, junto con biomarcadores cardiorrenales como la filtración glomerular y la proteinuria.
El objetivo de este estudio es: 1)valorar el estado de congestión al ingreso en pacientes con ICA mediante el protocolo VExUS; 2)describir las características iniciales según la puntuación VExUS al ingreso; 3)evaluar la prevalencia de NC al ingreso y las características iniciales, y 4)valorar el valor pronóstico del protocolo VExUS y otros marcadores de congestión y respuesta diurética relacionados con la ICA. (Ver resumen gráfico).
MétodosPoblación del estudioEstudio observacional y prospectivo realizado en la planta de Medicina Interna de un hospital de atención especializada entre 2022 y 2024. Los criterios de inclusión fueron: 1)edad >18años; 2)propéptido natriurético cerebral N-terminal (NT-proBNP) >1.000pg/ml; 3)signos y síntomas de congestión debida a IC, y 4)firma del consentimiento informado. Los criterios de exclusión fueron: 1)ingreso previo en la UCI; 2)deterioro del estado cognitivo o funcional; 3)nefropatía terminal (diálisis/trasplante renal), y 4)enfermedad pulmonar obstructiva crónica avanzada, definida como un volumen espiratorio máximo en el primer segundo (FEV1) <30%.
Evaluación multimodal de la congestiónLa evaluación de la congestión se realizó por diferentes métodos durante las primeras 24horas del ingreso. La congestión clínica se calculó mediante un índice simplificado de congestión clínica3 (material complementario, tabla S1). La congestión pulmonar tisular se cuantificó mediante la identificación de líneasB significativas (≥3 líneas) en cada cuadrante explorado (8 en total) y la presencia de derrame pleural. La congestión vascular se calculó mediante el análisis de la morfología de la VCI y el diámetro inspiratorio y espiratorio se calculó mediante el modo «M». El protocolo VExUS se calculó según Beaubien-Souligny et al.7. Se clasificó a los pacientes en el momento del ingreso como «congestión vascular baja» si la puntuación VExUS total era de 0-1, y como «congestión vascular alta» si la puntuación VExUS era de grado2 y3.
Todas las mediciones ecográficas fueron realizadas con un ecógrafo Mylab Omega utilizando una sonda sectorial y curvilineal (Esaote®) por dos investigadores con amplia experiencia en la evaluación multimodal de la congestión en la IC. En el caso de imágenes de baja calidad o patrones de flujo venoso no habituales, ambos médicos comentaban el caso. En caso de discordancia entre ambos investigadores, las exploraciones eran censuradas.
La nefropatía congestiva se definió como una filtración glomerular estimada según la fórmula de CKD-EPI-creatinina (FGe)<60 ml/min/1,73m2 o una microalbuminuria >30mg/g en presencia de un patrón venoso renal no continuo (gradosII yIII).
Análisis de laboratorioLa primera mañana del ingreso se realizó un análisis de sangre completo. Se determinaron las concentraciones de NT-proBNP y CA125 (análisis Elecsys® NT-proBNP y CA125® de Roche). Los biomarcadores urinarios se determinaron en muestras de orina puntuales recogidas entre dos y tres horas después del primer bolo de furosemida endovenosa matutina, el día del ingreso.
Análisis estadísticoLas variables continuas se expresaron como media ±desviación típica o mediana [intervalo intercuartílico] según la prueba de normalidad de Saphiro-Wilk. Las variables cualitativas se expresaron como porcentajes.
Las características iniciales de los pacientes se estratificaron primero según la puntuación VExUS, y segundo, según la presencia de NC. La distinción entre los grupos se evaluó adecuadamente mediante el ANOVA unidireccional o la prueba de Kruskal-Wallis H para las variables continuas y la prueba de la χ2 para las variables categóricas.
El criterio de valoración principal fue la combinación de mortalidad global y reingresos por IC a los 365días. La diferencia entre los grupos para el criterio de valoración principal se estudió con curvas de Kaplan-Meier y pruebas del orden logarítmico. Los posibles factores predictivos del criterio de valoración principal se identificaron mediante análisis de regresión logística univariante y multivariante. La lista de las variables candidatas para el análisis multivariante se consideraron con un valor de p≤0,2 en el análisis descriptivo entre los grupos de fallecidos y supervivientes a los 365días, y las variables para las que se había descrito verosimilitud biológica previa.
Se presentan estimaciones con intervalos de confianza del 95%. Se consideró estadísticamente significativo un valor de p<0,05. Todos los análisis se realizaron utilizando paquetes estadísticos del lenguaje de programación Python. El estudio se realizó siguiendo las recomendaciones contenidas en la declaración internacional de Helsinki y aprobadas por el Comité de Ética de Investigación Sanitaria de Aragón.
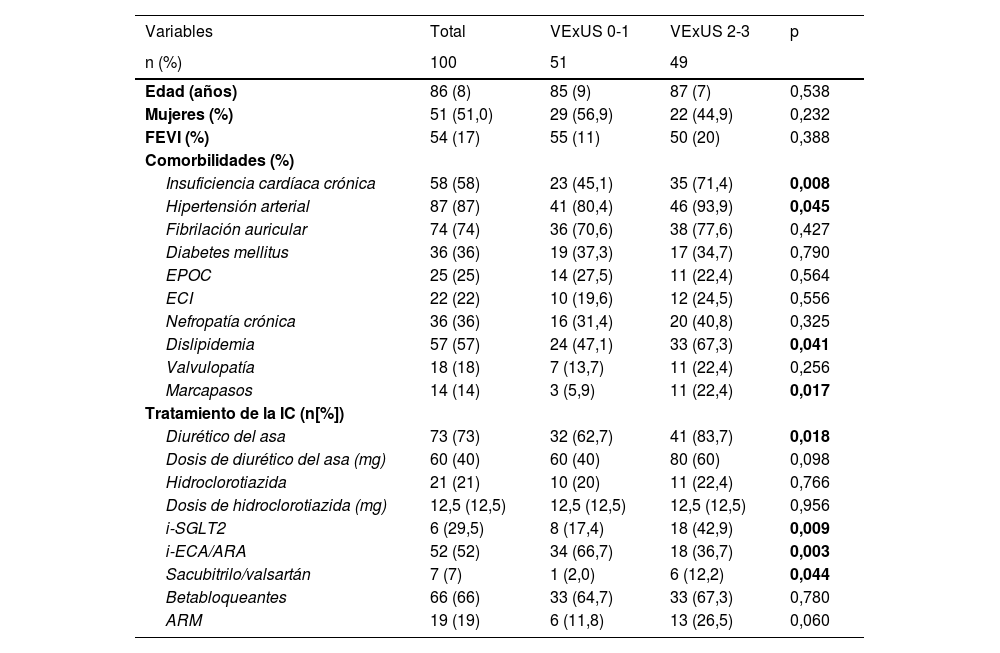
ResultadosInicialmente se reclutaron 102 pacientes para el análisis principal. Primero se excluyó del análisis a dos pacientes por falta de datos de puntuación VExUS al ingreso. La población final incluida en el análisis fue de 100 pacientes con ICA, con una edad media de 86años (8), una proporción ligeramente mayor de mujeres (51,0%) y una prevalencia elevada de comorbilidades, siendo la hipertensión (87%), la fibrilación auricular (74%) y la dislipidemia (57%) las más prevalentes. Más de la mitad habían sido ingresados anteriormente por ICA (58%), con una mediana de la fracción de expulsión del ventrículo izquierdo del 54% (17) (tabla 1).
Características iniciales según congestión venosa sistémica significativa por protocolo ecográfico de exceso venoso (VExUS) al ingreso
| Variables | Total | VExUS 0-1 | VExUS 2-3 | p |
|---|---|---|---|---|
| n (%) | 100 | 51 | 49 | |
| Edad (años) | 86 (8) | 85 (9) | 87 (7) | 0,538 |
| Mujeres (%) | 51 (51,0) | 29 (56,9) | 22 (44,9) | 0,232 |
| FEVI (%) | 54 (17) | 55 (11) | 50 (20) | 0,388 |
| Comorbilidades (%) | ||||
| Insuficiencia cardíaca crónica | 58 (58) | 23 (45,1) | 35 (71,4) | 0,008 |
| Hipertensión arterial | 87 (87) | 41 (80,4) | 46 (93,9) | 0,045 |
| Fibrilación auricular | 74 (74) | 36 (70,6) | 38 (77,6) | 0,427 |
| Diabetes mellitus | 36 (36) | 19 (37,3) | 17 (34,7) | 0,790 |
| EPOC | 25 (25) | 14 (27,5) | 11 (22,4) | 0,564 |
| ECI | 22 (22) | 10 (19,6) | 12 (24,5) | 0,556 |
| Nefropatía crónica | 36 (36) | 16 (31,4) | 20 (40,8) | 0,325 |
| Dislipidemia | 57 (57) | 24 (47,1) | 33 (67,3) | 0,041 |
| Valvulopatía | 18 (18) | 7 (13,7) | 11 (22,4) | 0,256 |
| Marcapasos | 14 (14) | 3 (5,9) | 11 (22,4) | 0,017 |
| Tratamiento de la IC (n[%]) | ||||
| Diurético del asa | 73 (73) | 32 (62,7) | 41 (83,7) | 0,018 |
| Dosis de diurético del asa (mg) | 60 (40) | 60 (40) | 80 (60) | 0,098 |
| Hidroclorotiazida | 21 (21) | 10 (20) | 11 (22,4) | 0,766 |
| Dosis de hidroclorotiazida (mg) | 12,5 (12,5) | 12,5 (12,5) | 12,5 (12,5) | 0,956 |
| i-SGLT2 | 6 (29,5) | 8 (17,4) | 18 (42,9) | 0,009 |
| i-ECA/ARA | 52 (52) | 34 (66,7) | 18 (36,7) | 0,003 |
| Sacubitrilo/valsartán | 7 (7) | 1 (2,0) | 6 (12,2) | 0,044 |
| Betabloqueantes | 66 (66) | 33 (64,7) | 33 (67,3) | 0,780 |
| ARM | 19 (19) | 6 (11,8) | 13 (26,5) | 0,060 |
| Variables | Total | VExUS 0-1 | VExUS 2-3 | p |
|---|---|---|---|---|
| n (%) | 100 | 51 | 49 | |
| Congestión clínica n (%) | ||||
| Ortopnea | 0,009 | |||
| 1 almohada | 34 (34,3) | 23 (46,0) | 11 (22,4) | |
| 2 almohadas | 29 (29,3) | 13 (26,0) | 16 (32,7) | |
| > 30 grados | 28 (28,3) | 8 (16,0) | 20 (40,8) | |
| Edemas | <0,001 | |||
| Leve | 27 (27,3) | 16 (32,0) | 11 (22,4) | |
| Moderado | 34 (34,3) | 19 (38,0) | 15 (30,6) | |
| Grave | 17 (17,2) | 1 (2,0) | 16 (16,2) | |
| Distensión de la vena yugular | 0,019 | |||
| <6 cm | 16 (16,2) | 8 (16,0) | 8 (16,3) | |
| 6-10 cm | 53 (69,7) | 33 (66,0) | 20 (40,8) | |
| 10 cm | 30 (30,3) | 9 (18,0) | 21 (42,9) | |
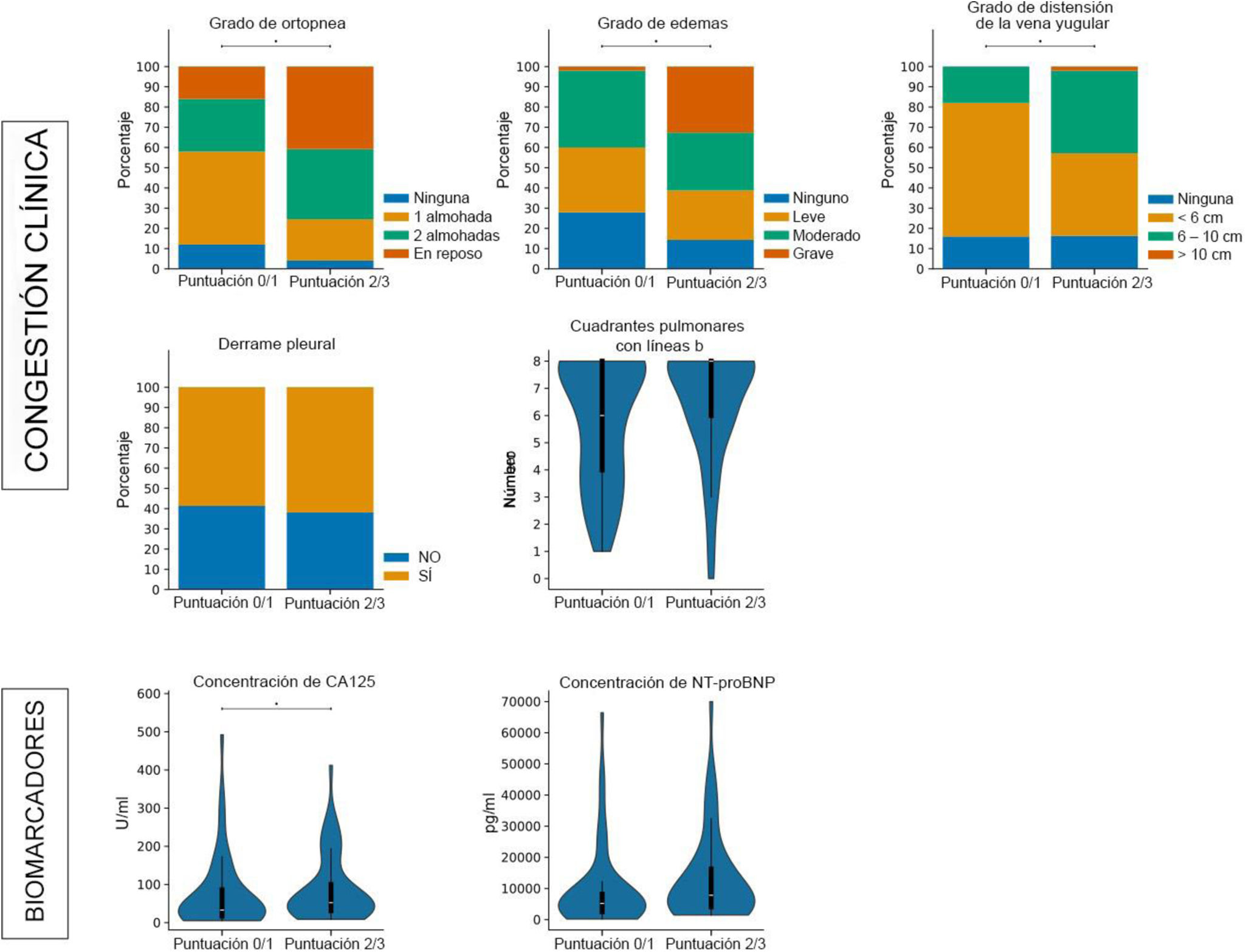
| Puntuación combinada de congestión clínica (puntos) | 4 (3) | 4 (2) | 5 (2) | <0,001 |
| Congestión pulmonar intersticial, n (%) | ||||
| Total de cuadrantes pulmonares con líneas b significativas (≥ 3) | 7 (4) | 6 (4) | 8 (2) | 0,181 |
| Presencia de derrame pleural | 54 (54) | 27 (58,7) | 27 (64,3) | 0,591 |
| Congestión intravascular | ||||
| Diámetro de la VCI (mm) | 22 (5) | 20 (5) | 23 (6) | <0,001 |
| Colapsabilidad de la VCI (n [%]) | 23 (23) | 19 (38,0) | 4 (8,5) | <0,001 |
| Ecografía doppler de la vena suprahepática (n [%]) | <0,001 | |||
| S> D | 21 (23) | 20 (40) | 1 (2,4) | |
| D> S | 39 (43) | 29 (58) | 10 (24) | |
| Flujo inverso | 31 (34) | 1 (2) | 30 (73) | |
| Ecografía doppler de la vena porta (n[%]) | <0,001 | |||
| Flujo normal | 30 (33) | 24 (47) | 6 (15) | |
| < 50% de pulsabilidad | 34 (37) | 23 (45) | 11 (27) | |
| Pulsabilidad de 50 o inversión | 27 (30) | 4 (7) | 23 (57) | |
| Ecografía doppler de la vena renal (n[%]) | <0,001 | |||
| Flujo continuo | 54 (58) | 37 (78) | 17 (37) | |
| Flujo bifásico | 30 (32) | 9 (19) | 21 (45) | |
| Flujo monofásico | 9 (10) | 1 (2) | 8 (17) | |
| Biomarcadores | ||||
| NT-proBNP (pg/ml) | 5.574 (10.066) | 5.201 (5.548) | 7.560 (12.183) | 0,105 |
| CA125 (U/ml) | 46,3 (75,6) | 32,7 (75,2) | 53,2 (73,8) | 0,045 |
| Parámetros sanguíneos | ||||
| Ácido úrico (mg/dl) | 7,28±2,38 | 7,12±2,20 | 7,42±2,55 | 0,765 |
| Urea (mg/dl) | 60 (42) | 55 (35) | 66 (44) | 0,120 |
| Creatinina (mg/dl) | 1,23 (0,73) | 1,19 (0,81) | 1,27 (0,60) | 0,339 |
| eGFR (ml/min/1,73 m2) | 50 (28) | 52,5 (28,9) | 50,2 (25,5) | 0,611 |
| Sodio (mmol/l) | 142 (4) | 141 (5) | 141 (3) | 0,750 |
| Potasio (mmol/l) | 4,0 (0,5) | 4,0 (0,5) | 4,0 (0,6) | 0,361 |
| Cloruro (mmol/l) | 101 (5) | 101 (5) | 101 (6) | 0,877 |
| Sodio urinario (mmol/l) | 93 (50) | 93 (40) | 92 (53) | 0,736 |
| Cloruro urinario (mmol/l) | 89 (56) | 93 (54) | 84 (57) | 0,534 |
| Potasio urinario (mmol/l) | 23 (11) | 20 (9) | 25 (14) | 0,027 |
| Cociente microalbúmina/creatinina (mg/g) | 105 (210) | 80 (99) | 130 (230) | 0,007 |
| Hemoglobina (g/l) | 12,1 (3,0) | 11,8 (3,1) | 12,4 (2,8) | 0,350 |
| Hematócrito (%) | 36 (8) | 36 (9) | 38 (8) | 0,294 |
| Proteína C-reactiva (mg/dl) | 16 (32) | 18 (48) | 15 (24) | 0,834 |
| Furosemida endovenosa total | 415 (580) | 240 (346) | 545 (895) | 0,001 |
| Resultados | ||||
| MCC a 1 año | 28 (28) | 10 (10) | 18 (10) | 0,048 |
| Rehospitalización por IC a 1 año | 18 (18) | 7 (7) | 11 (11) | 0,327 |
| Resultado combinado a 1 año | 35 (35) | 17 (17) | 29 (29) | 0,046 |
ARM: antagonista de los receptores de mineralocorticoides; CA125: antígeno tumoral 125; CACO: cociente albúmina/creatinina en orina; DVY: distensión de la vena yugular; ECI: enfermedad coronaria isquémica; eGFR: filtración glomerular estimada; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de expulsión del ventrículo izquierdo; i.v.: intravenoso/a; IC: insuficiencia cardíaca; ICpFE: insuficiencia cardíaca con preservación de la fracción de expulsión; i-ECA: inhibidores de la enzima convertidora de la angiotensina; IRA: inhibidores del receptor de angiotensina; i-SGLT2: inhibidores del cotransportador2 de sodio-glucosa; MCC: mortalidad por cualquier causa; NCr: nefropatía crónica; NT-proBNP: propéptido natriurético cerebral N-terminal; VCI: vena cava inferior; VExUS: protocolo ecográfico de exceso venoso.
En negrita, p < 0,005 (significativo).
Según el protocolo de VExUS al ingreso, el 51% de los pacientes presentaban baja congestión vascular (VExUS 0-1) y el 49% presentaban alta congestión vascular (VExUS 2-3). Los pacientes con alta congestión vascular al ingreso presentaban una mayor prevalencia de IC crónica (71,4% frente al 45,1%; p=0,008), una mayor prevalencia de hipertensión (93,9% frente al 80,4%; p=0,045) y dislipidemia (67,3% frente al 47,1%; p=0,041) y tenían marcapasos en mayor proporción (22,4% frente al 5,9%; p=0,017). Según el tratamiento de la IC, los pacientes con alta congestión vascular fueron tratados con una mayor proporción de diuréticos del asa orales (83,7% frente al 62,7%; p=0,018), inhibidores del cotransportador de sodio-glucosa tipo2 (i-SGLT2) (42,9% frente al 17,4%; p=0,009), inhibidores del receptor de angiotensina/neprilisina (12,2% frente al 2,0%; p=0,044) y una mayor prescripción no significativa de antagonistas de los receptores de mineralocorticoides (26,5% frente al 11,8%; p=0,060) (tabla 1).
Los pacientes con alta congestión vascular presentaron una mayor puntuación de congestión clínica (5 puntos [2] frente a 4 puntos [3]; p=<0,001) y mayores concentraciones de antígeno tumoral 125 (CA125) (53 [73] U/ml frente a 32 [75] U/ml; p=0,045). No se observaron diferencias con respecto a la función renal (50,2 [25] ml/min/1,73m2 frente a 52,5 [28] ml/min/1,73m2; p=0,611) ni a la natriuresis (92 [53] mmol/l frente a 93 [40] mmol/l; p=0,736), pero se detectaron tasas más altas del cociente microalbúmina/creatinina en los pacientes con puntuaciones VExUS más altas (130 [230] mg/g frente a 80 [99] mg/g; p=0,027). Por último, los pacientes del grupo de alta congestión vascular necesitaron dosis significativas más altas de furosemida endovenosa durante las primeras 72horas tras el ingreso (545 [895] mg frente a 240 [346] mg; p=0,001) (tabla 1 y fig. 1).
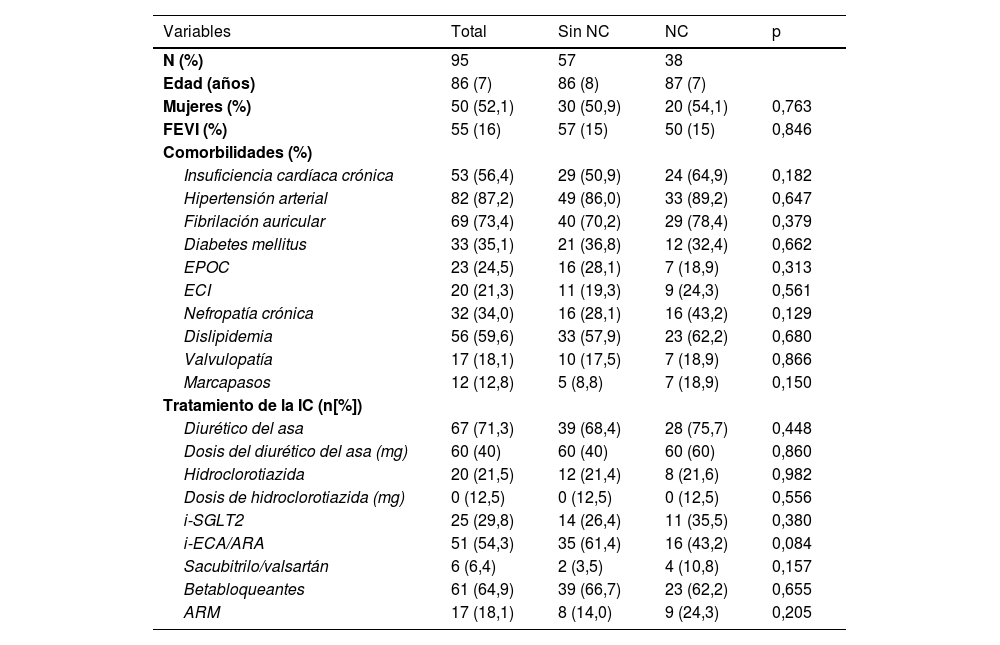
Características iniciales según la nefropatía congestiva en el momento del ingresoFinalmente se incluyeron 95 pacientes para evaluar la presencia de NC. En nuestra población se detectó una prevalencia de NC del 38% al ingreso. Las características iniciales eran similares en ambos grupos, aunque la tendencia de los pacientes con NC fue a ser tratados en menor proporción con inhibidores de la enzima convertidora de la angiotensina (i-ECA) y antagonistas de los receptores de mineralocorticoides (ARM) (43,2% frente al 61,4%; p=0,084). Según la evaluación multimodal de la congestión, los pacientes con NC mostraron tasas significativamente mayores de puntuación de congestión clínica (p=0,004), especialmente en lo que respecta a la presencia de edemas significativos (p=0,023) y de distensión de la vena yugular (p=0,001). El análisis Doppler de venas suprahepáticas y porta confirmó la presencia significativa de congestión hepática (p<0,001 y p<0,001, respectivamente) y mayor grado VExUS (p<0,001) (material complementario, fig. S1). Los biomarcadores de congestión también fueron mayores en los pacientes con NC, con medianas de concentraciones de NT-proBNP al ingreso de 7.851 [13.063] pg/ml frente a 4.984 [5.935] pg/ml (p<0,025) y medianas de concentraciones de CA125 de 47,0 [50] U/ml frente a 34,2 [84] U/ml (p<0,077). Cabe destacar que los pacientes con NC recibieron dosis más altas de furosemida endovenosa durante las primeras 72horas tras el ingreso (518 [1.050] mg frente a 280 [453] mg; p=0,010) (tabla 2). No se observó una asociación significativa entre la NC y los resultados a largo plazo en nuestra cohorte.
Características iniciales según la nefropatía congestiva (NC) al ingreso
| Variables | Total | Sin NC | NC | p |
|---|---|---|---|---|
| N (%) | 95 | 57 | 38 | |
| Edad (años) | 86 (7) | 86 (8) | 87 (7) | |
| Mujeres (%) | 50 (52,1) | 30 (50,9) | 20 (54,1) | 0,763 |
| FEVI (%) | 55 (16) | 57 (15) | 50 (15) | 0,846 |
| Comorbilidades (%) | ||||
| Insuficiencia cardíaca crónica | 53 (56,4) | 29 (50,9) | 24 (64,9) | 0,182 |
| Hipertensión arterial | 82 (87,2) | 49 (86,0) | 33 (89,2) | 0,647 |
| Fibrilación auricular | 69 (73,4) | 40 (70,2) | 29 (78,4) | 0,379 |
| Diabetes mellitus | 33 (35,1) | 21 (36,8) | 12 (32,4) | 0,662 |
| EPOC | 23 (24,5) | 16 (28,1) | 7 (18,9) | 0,313 |
| ECI | 20 (21,3) | 11 (19,3) | 9 (24,3) | 0,561 |
| Nefropatía crónica | 32 (34,0) | 16 (28,1) | 16 (43,2) | 0,129 |
| Dislipidemia | 56 (59,6) | 33 (57,9) | 23 (62,2) | 0,680 |
| Valvulopatía | 17 (18,1) | 10 (17,5) | 7 (18,9) | 0,866 |
| Marcapasos | 12 (12,8) | 5 (8,8) | 7 (18,9) | 0,150 |
| Tratamiento de la IC (n[%]) | ||||
| Diurético del asa | 67 (71,3) | 39 (68,4) | 28 (75,7) | 0,448 |
| Dosis del diurético del asa (mg) | 60 (40) | 60 (40) | 60 (60) | 0,860 |
| Hidroclorotiazida | 20 (21,5) | 12 (21,4) | 8 (21,6) | 0,982 |
| Dosis de hidroclorotiazida (mg) | 0 (12,5) | 0 (12,5) | 0 (12,5) | 0,556 |
| i-SGLT2 | 25 (29,8) | 14 (26,4) | 11 (35,5) | 0,380 |
| i-ECA/ARA | 51 (54,3) | 35 (61,4) | 16 (43,2) | 0,084 |
| Sacubitrilo/valsartán | 6 (6,4) | 2 (3,5) | 4 (10,8) | 0,157 |
| Betabloqueantes | 61 (64,9) | 39 (66,7) | 23 (62,2) | 0,655 |
| ARM | 17 (18,1) | 8 (14,0) | 9 (24,3) | 0,205 |
| Variables | Total | Sin NC | n | Valor de p |
|---|---|---|---|---|
| N (%) | 94 | 57 (60,6) | 37 (39,4) | |
| Congestión clínica n (%) | ||||
| Ortopnea | 0,670 | |||
| 1 almohada | 31 (33,3) | 20 (35,7) | 11 (29,7) | |
| 2 almohadas | 26 (28,0) | 15 (26,8) | 11 (29,7) | |
| >30 grados | 28 (30,1) | 15 (26,8) | 13 (35,1) | |
| Edemas | 0,023 | |||
| Leve | 22 (23,7) | 13 (23,2) | 9 (24,3) | |
| Moderado | 33 (35,5) | 22 (39,3) | 11 (29,7) | |
| Grave | 17 (18,3) | 5 (8,9) | 12 (32,4) | |
| Distensión de la vena yugular | 0,001 | |||
| <6 cm | 16 (17,2) | 9 (16,1) | 7 (18,9) | |
| 6-10 cm | 50 (53,8) | 38 (67,9) | 12 (32,4) | |
| 10 cm | 27 (29,0) | 9 (16,1) | 18 (48,6) | |
| Puntuación combinada de congestión clínica (puntos) | 4 (3) | 4 (2) | 5 (3) | 0,004 |
| Congestión pulmonar intersticial, n (%) | ||||
| Total de cuadrantes pulmonares con líneas b significativas (≥ 3) | 7 (4) | 7 (4) | 7 (2) | 0,195 |
| Presencia de derrame pleural | 51 (60,7) | 33 (62,3) | 18 (58,1) | 0,704 |
| Congestión intravascular | ||||
| Diámetro de la VCI (mm) | 22 (5) | 21 (5) | 22 (5) | 0,142 |
| Ecografía doppler de la vena suprahepática (n [%]) | <0,001 | |||
| S> D | 20 (23,5) | 19 (33,9) | 1 (3,4) | |
| D> S | 35 (41,2) | 25 (44,6) | 10 (34,5) | |
| Flujo inverso | 30 (35,3) | 12 (21,4) | 18 (62,1) | |
| Ecografía doppler de la vena porta (n[%]) | <0,001 | |||
| Flujo normal | 29 (34,1) | 27 (48,2) | 2 (6,9) | |
| <50% de pulsabilidad | 31 (36,5) | 18 (32,1) | 13 (44,8) | |
| Pulsabilidad de 50 o inversión | 25 (29,4) | 11 (19,6) | 14 (48,3) | |
| Ecografía doppler de la vena renal (n[%]) | <0,001 | |||
| Flujo continuo | 54 (58,7) | 52 (91,2) | 2 (5,7) | |
| Flujo bifásico | 29 (31,5) | 5 (8,8) | 24 (68,6) | |
| Flujo monofásico | 9 (9,8) | 0 (0,0) | 9 (25,7) | |
| Biomarcadores | ||||
| NT-proBNP (pg/ml) | 5.534 (9.267) | 4.984 (5.935) | 7.851 (13.063) | 0,025 |
| CA125 (U/ml) | 46,8 (76) | 34,2 (84,9) | 47,0 (50,2) | 0,077 |
| Parámetros sanguíneos | ||||
| Ácido úrico (mg/dl) | 7,2 (3,9) | 6,9 (2,7) | 7,8 (4,4) | 0,109 |
| Urea (mg/dl) | 59 (41) | 52 (28) | 72 (39) | 0,003 |
| Creatinina (mg/dl) | 1,33 (0,66) | 1,12 (0,56) | 1,39 (0,66) | 0,030 |
| eGFR (ml/min/1,73m2) | 51 (28) | 56 (27) | 42 (23) | 0,004 |
| Sodio (mmol/l) | 142 (3) | 142 (4) | 141 (3) | 0,856 |
| Potasio (mmol/l) | 4,0 (0,5) | 4,0 (0,5) | 4,2 (0,6) | 0,229 |
| Cloruro (mmol/l) | 101 (5) | 101 (4) | 101 (7) | 0,816 |
| Sodio urinario (mmol/l) | 93 (48) | 94 (42) | 84 (57) | 0,856 |
| Cloruro urinario (mmol/l) | 90 (57) | 90 (52) | 88 (63) | 0,816 |
| Potasio urinario (mmol/l) | 23 (12) | 21 (10) | 27 (16) | 0,229 |
| Cociente microalbúmina/creatinina (mg/g) | 105 (208) | 92 (139) | 129 (229) | 0,014 |
| Hemoglobina (g/l) | 12,1 (2,9) | 12,1 (3,3) | 12,2 (2,7) | 0,991 |
| Hematócrito (%) | 37,0 (8,3) | 37 (8) | 37 (8) | 0,908 |
| Proteína C-reactiva (mg/dl) | 16 (32) | 16 (29) | 20 (56) | 0,425 |
| Furosemida endovenosa total | 400 (555) | 280 (453) | 518 (1050) | 0,010 |
| Resultados | ||||
| MCC a 1 año | 27 (28,4) | 15 (8,5) | 12 (4,5) | 0,557 |
| Rehospitalización por IC a 1 año | 17 (17,8) | 11 (6,2) | 6 (2,2) | 0,662 |
| Resultado combinado a 1 año | 24 (25,2) | 9 (5,1) | 15 (5,7) | 0,540 |
ARM: antagonista de los receptores de mineralocorticoides; CA125: antígeno tumoral 125; CACO: cociente albúmina/creatinina en orina; DVY: distensión de la vena yugular; ECI: enfermedad coronaria isquémica; eGFR: filtración glomerular estimada; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de expulsión del ventrículo izquierdo; i.v.: intravenoso/a; IC: insuficiencia cardíaca; ICpFE: insuficiencia cardíaca con preservación de la fracción de expulsión; i-ECA: inhibidores de la enzima convertidora de la angiotensina; IRA inhibidores del receptor de angiotensina; i-SGLT2: inhibidores del cotransportador2 de sodio-glucosa; MCC: mortalidad por cualquier causa; NCr: nefropatía crónica; NT-proBNP: propéptido natriurético cerebral N-terminal; VCI: vena cava inferior; VExUS: protocolo ecográfico de exceso venoso.
En negrita, p < 0,005 (significativo).
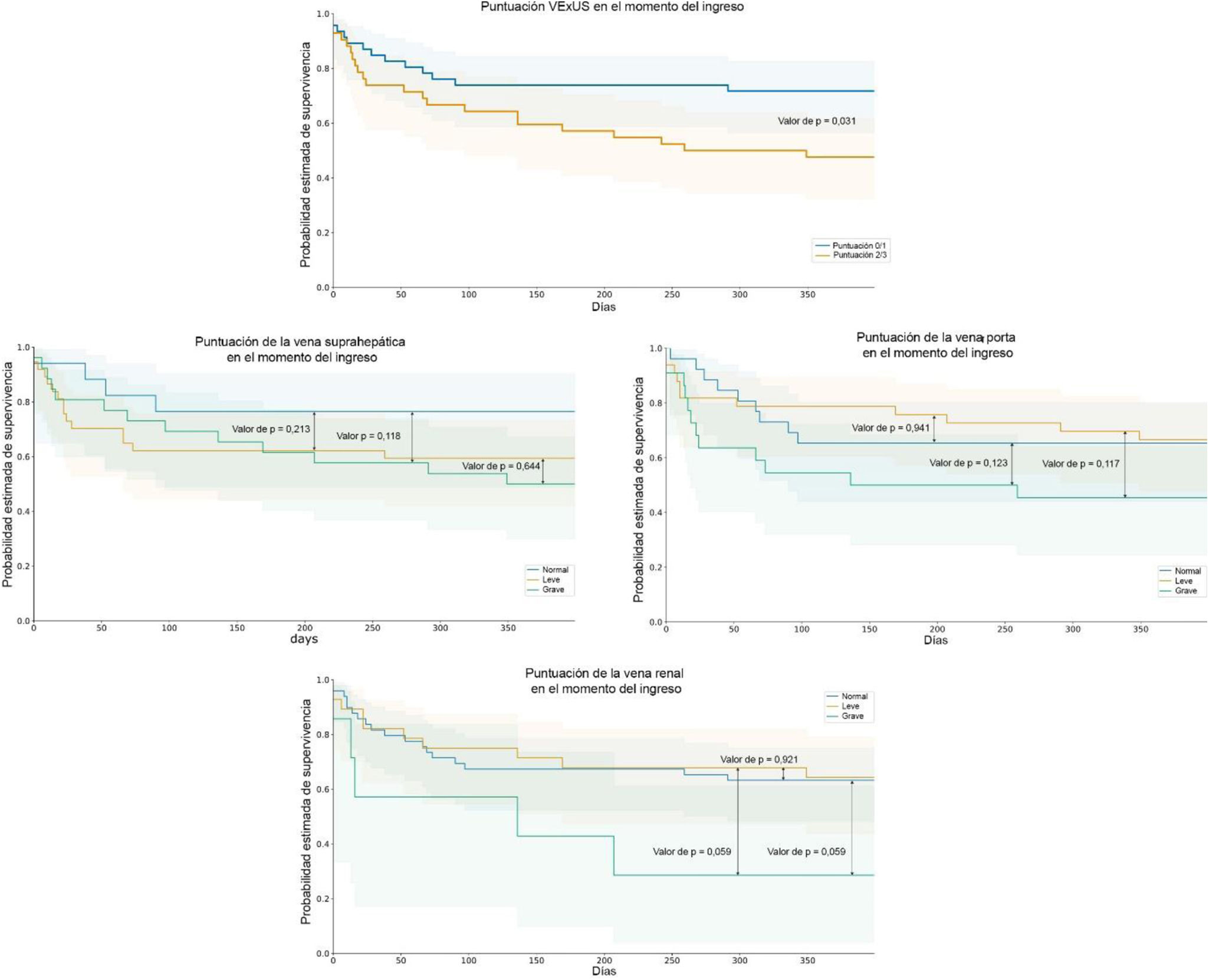
De los 100 pacientes finalmente incluidos, 28 habían fallecido hasta el día 365 y 18 fueron rehospitalizados por un nuevo episodio de IC. Los pacientes con congestión vascular elevada (puntuación VExUS de 2-3) en el momento del ingreso registraron una mayor proporción del criterio de valoración principal combinado (rehospitalizaciones por IC o mortalidad global después de 365días) (p=0,048), y las gráficas de Kaplan-Meier de la figura 2 también mostraron una tasa significativa (prueba del orden logarítmico=0,031). El riesgo para el criterio de valoración principal hasta el día365 fue más de dos veces mayor en los pacientes con puntuaciones VExUS más altas al ingreso (odds ratio, 2,52; IC95%: 1,02-6,26; p=0,046), aunque, tras un ajuste multifactorial, se perdió la significación de la puntuación VExUS por encima de las variables más potentes (tabla 3). En el análisis multivariante, los niveles elevados de urea, el mayor diámetro de la vena cava inferior y el sexo masculino se identificaron como predictores independientes, además de la puntuación VExUS, para la mortalidad a un año, con un área bajo la curva para el modelo final de 0,740 (p<0,001).
Análisis de regresión logística uni y multivariante según los parámetros de ingreso para el criterio de valoración combinado principal (mortalidad por cualquier causa a 1año)
| Univariante | Multivariante | ||||
|---|---|---|---|---|---|
| Variable | HR (IC 95%) | p | Variable | HR (IC 95%) | p |
| CCS (puntos)* | 1,97 (1,14-3,41) | 0,014 | |||
| Creatinina (mg/dl)* | 2,14 (1,29-3,56) | 0,003 | |||
| Cloruro urinario (mmol/l)* | 0,66 (0,42-1,04) | 0,075 | |||
| NT-proBNP (pg/ml)* | 1,61 (1,01-2,57) | 0,045 | |||
| Urea (mg/dl)* | 2,80 (1,60-4,91) | 0,001 | Urea (mg/dl)* | 2,88 (1,56-5,30) | <0,001 |
| Sodio urinario (mmol/l)* | 0,68 (0,43-1,07) | 0,095 | |||
| Sodio (mmol/l)* | 0,77 (0,50-1,19) | 0,244 | |||
| Ácido úrico (mg/dl)* | 2,09 (1,22-3,59) | 0,007 | |||
| Hematócrito (%) | 0,63 (0,39-1,00) | 0,053 | |||
| Edad (años)* | 1,89 (1,05-3,37) | 0,032 | |||
| Hemoglobina (g/l) | 0,66 (0,42-1,05) | 0,080 | |||
| Dosis del diurético del asa antes del ingreso (mg)* | 0,66 (0,43-1,02) | 0,061 | |||
| Dosis total i.v. Dosis de diurético del asa administrada durante las primeras 24 horas | 1,86 (1,16-2,98) | 0,010 | |||
| Diámetro de la VCI (mm)* | 1,99 (1,21-3,27) | 0,006 | Diámetro de la VCI (mm)* | 1,94 (1,10-3,39) | 0,021 |
| eGFR (ml/min/1,72 m2) | 0,48 (0,29-0,82) | 0,006 | |||
| VExUS II-III | 2,52 (1,02-6,26) | 0,046 | |||
| Presencia de ortopnea moderada/grave | 1,83 (0,74-4,59) | 0,192 | |||
| Edema | 1,81 (0,73-4,45) | 0,199 | |||
| FEVI(%) | 1,01 (0,65-1,57) | 0,980 | |||
| Presencia de nefropatía congestiva al ingreso | 1,45 (0,58-3,60) | 0,428 | |||
| Sexo (varón) | 3,53 (1,35-9,22) | 0,009 | Sexo (varón) | 4,21 (1,38-12,86) | 0,011 |
Área bajo la curva (AUC) del modelo de regresión logística multivariante 0,740 (p<0,001) (sensibilidad 62,1%; especificidad 86,9%; R2 0,26; exactitud 78,8%).
En negrita, p < 0,005 (significativo).
En este estudio observacional unicéntrico realizado en pacientes con ICA observamos una elevada proporción (alrededor del 50%) de alta congestión vascular (VExUS 2-3) en el momento del ingreso. Este mayor grado de congestión se correlacionó con peores resultados en cuanto a mortalidad total o reingresos por IC en el primer año tras el alta, lo que refuerza el valor de esta herramienta en el tratamiento de los pacientes con ICA.
Desde su introducción, el protocolo VExUS ha generado interés y evidencia en entornos críticos y, más recientemente, en la IC como marcador de congestión vascular y visceral. En nuestra muestra, el grado de congestión vascular evaluado mediante VExUS fue elevado, de modo que los pacientes con mayor congestión (grados2 y3 de VExUS) presentaron más enfermedades concomitantes y recibieron dosis más altas de tratamiento diurético, como furosemida, i-SGLT2 y ARM. Este hallazgo indica un estadio más avanzado de IC o un tratamiento descongestivo más intensivo. En este contexto, la resistencia a los diuréticos se indica por la necesidad de dosis más altas para lograr la descongestión, así como por la implementación del bloqueo secuencial de la nefrona. Aunque las concentraciones absolutas de creatinina no difirieron entre los grupos, creemos que la creatinina por sí sola no siempre refleja la funcionalidad de la nefrona. Cabe destacar que, en nuestra cohorte, la albuminuria fue más prevalente en los pacientes con grados VExUS más altos, lo que podría estar relacionado con la resistencia a los diuréticos. Además, al analizar los parámetros clínicos y analíticos, el protocolo VExUS se correlacionó bien con parámetros clínicos de congestión y biomarcadores como NT-proBNP y CA125, aunque solo CA125 alcanzó significación estadística (debido probablemente a un tamaño de muestra insuficiente). Aunque los péptidos natriuréticos se asocian más a sobrecarga de volumen y distensión de las cavidades cardíacas, parece que CA125 está más relacionado con inflamación sistémica y congestión venosa extravascular, sobre todo porque VExUS capta signos de congestión más allá de la vasculatura. Estos hallazgos coinciden con los de estudios previamente publicados sobre VExUS en la IC7-9,11, lo que refuerza la validez externa de nuestros resultados.
Sin embargo, el aspecto más novedoso e interesante de nuestro estudio está relacionado con la detección de nefropatía congestiva y necesidad de diuréticos durante las primeras horas de hospitalización. Según la definición de la NC para este estudio, casi el 40% presentaban esta afección. Estos resultados concuerdan con los publicados por De la Espriella et al.12, aunque la incidencia en nuestra muestra fue menor, probablemente debido a la ausencia de una definición normalizada de nefropatía congestiva.
No obstante, estos resultados tienen implicaciones importantes desde múltiples perspectivas. En primer lugar, respaldan la hipótesis de que la congestión es el principal factor impulsor del deterioro transitorio de la función renal al ingreso por ICA. En segundo lugar, de acuerdo con estudios previos13,14, nuestros resultados indican que la microalbuminuria podría ser útil como biomarcador urinario de congestión clínica. En tercer lugar, desde el punto de vista mecanicista, nuestros hallazgos ponen de manifiesto la compleja interacción fisiopatológica de la congestión, que actúa a la vez como consecuencia y como posible causa de la disfunción orgánica, especialmente la renal, con importantes implicaciones terapéuticas. En este contexto, el estudio de mecanismos intrínsecos de lesión renal por congestión sugiere el papel clave de la presión intraabdominal, que puede contribuir a la compresión de estructuras renales mayores15. Esto podría explicar la necesidad de dosis mayores de diuréticos (reflejo de una peor respuesta diurética) y de concentraciones más elevadas de ratios de microalbuminuria en los pacientes con IC con mayor grado de congestión vascular intraabdominal determinada mediante VExUS. Por último, a tenor de lo anterior, el protocolo VExUS podría representar una herramienta valiosa para diseñar estrategias terapéuticas descongestivas a medida, especialmente en los pacientes con NC, en los que existen un empeoramiento y un pseudoempeoramiento de la función renal difíciles de evaluar en el contexto clínico únicamente mediante exploración física. En este sentido, un reciente ensayo clínico16 demostró que la descongestión guiada por VExUS frente al tratamiento de referencia en pacientes con síndrome cardiorrenal de tipo1 no mejoró la recuperación de la función renal pero sí mejoró las posibilidades de lograr la descongestión.
Eventos pronósticosLas tasas de mortalidad y reingreso en el contexto de la IC están aumentando en general y la estratificación del riesgo podría resultar complicada. Torres-Arrese et al.17 han señalado el papel de la ecografía en la valoración del pronóstico. Identificaron una pulsatilidad de la vena porta >50%, un patrón renal monofásico y un grado3 de VExUS como factores predictivos de mortalidad intrahospitalaria en los pacientes ingresados por IC. Nuestros resultados son similares a los suyos y demuestran que la aplicación de VExUS al ingreso permite identificar a los pacientes con mayor congestión y peores resultados a medio plazo. Recientemente, De la Espriella et al.12 llegaron a la conclusión de que el flujo renal discontinuo identifica mayores tasas de empeoramiento de la función renal y mayores tasas de acontecimientos adversos. En los últimos meses Sovetova et al.18 publicaron un estudio similar al nuestro en el que demostraron que el grado3 de VExUS se asociaba en gran medida a un empeoramiento de la función renal, una reducción de la respuesta natriurética, un aumento de la resistencia a los diuréticos y mayor incidencia de mortalidad hospitalaria. También se observó que los patrones monofásicos de flujo renal y flujo portal anormal comportaban un mayor riesgo de acontecimientos adversos.
Sin embargo, nuestros datos no respaldaron el valor aislado del flujo portal, si bien el flujo renal estuvo muy próximo a alcanzar significación estadística en el análisis de regresión de la supervivencia al cabo de un año de seguimiento, lo que indica una función pronóstica importante que justifica una investigación más profunda. Probablemente esta falta de evidencia podría deberse a un número limitado de pacientes con alteraciones de grado3, y desafíos relacionados con factores antropométricos y con la naturaleza dependiente del operador de la realización de la ecografía. Sin embargo, sigue existiendo controversia sobre el uso del flujo renal doppler, ya que algunos autores argumentan que este método puede llevar mucho tiempo19, lo que contrasta con trabajos previos que destacan su valor clínico. Esta incoherencia justifica una explicación más detallada para comprender mejor su repercusión y su relevancia.
Lo que resulta más interesante es que en nuestra cohorte no se constató una asociación significativa entre la NC y los resultados a largo plazo. Esta divergencia con respecto a los estudios previos, como los de Damman et al.20,21, que identificaron a la NC como marcador pronóstico, puede deberse a diferencias en las poblaciones de pacientes, las definiciones o los ajustes estadísticos. Los futuros estudios deben investigar si los tratamientos personalizados dirigidos a la NC pueden modificar los resultados.
El análisis multivariante pone de manifiesto el valor pronóstico independiente de los niveles elevados de urea, el mayor diámetro de la VCI y el sexo masculino para predecir la mortalidad a un año en la IC. Estos hallazgos son coherentes con el papel establecido de la disfunción renal y la hipervolemia como principales marcadores pronósticos de la IC. La urea surgió como un factor predictivo significativo de los resultados en este estudio, mientras que la creatinina no mostró el mismo valor pronóstico, lo que podría atribuirse a la mayor sensibilidad de la urea a la congestión sistémica y la hipervolemia. Aunque la creatinina es un marcador de la función renal de uso frecuente, los niveles de urea pueden reflejar cambios más rápidos en el balance hídrico y la perfusión renal, como se describió hace años22,23. Además, el sexo masculino se identificó como un factor predictivo significativo de peores resultados, debido potencialmente a una mayor prevalencia de etiología isquémica y comorbilidades como diabetes y disfunción renal24,25.
Lo que resulta más interesante es que el diámetro de la VCI aparece como un factor predictivo significativo en el análisis multivariante, mientras que VExUS no lo hace, lo que resulta controvertido dado que otros estudios respaldan el uso de VExUS por delante de la VCI, tal como se ha mencionado anteriormente. Quizá podría explicarse porque la VCI es un parámetro objetivo, único y sencillo y la puntuación VExUS supone una evaluación múltiple de los parámetros, lo que introduce intrínsecamente una mayor variabilidad en los resultados. Nuestro grupo está trabajando en algoritmos de segmentación automática para minimizar la variabilidad de la interpretación y reducir estos inconvenientes26. Además, debe tenerse en cuenta que los pacientes con hipertensión pulmonar pueden presentar un mayor diámetro de la VCI, lo que podría influir en el valor predictivo de la VCI en nuestro análisis. Estudios previos han demostrado el valor pronóstico de VExUS; sin embargo, nuestros hallazgos apoyan la idea de que los marcadores de la función renal y la congestión siguen desempeñando un papel central en la estratificación del riesgo para los pacientes con IC. Aunque VExUS puede aportar información pronóstica adicional, su valor predictivo podría verse limitado por variables de confusión y podría beneficiarse de su uso junto con otros parámetros clínicos para potenciar su utilidad en la práctica clínica27.
Puntos fuertes y limitacionesLos puntos fuertes de este estudio son su diseño prospectivo, la aplicación normalizada del protocolo VExUS y la evaluación multiparamétrica de la congestión. Sin embargo, tiene varios inconvenientes, como la falta de una definición universal de la NC, la ausencia de datos sobre hipertensión pulmonar, el grado de insuficiencia ventricular derecha sin evaluación TAPSE, así como su diseño unicéntrico, que limitan la posibilidad de generalizar los resultados a otros ámbitos sanitarios.
Investigaciones futurasLas futuras investigaciones deberían explorar si los tratamientos guiados por VExUS pueden mejorar los resultados a largo plazo. Los ensayos aleatorizados y controlados en los que se investiga VExUS como herramienta de toma de decisiones para el ajuste de los diuréticos podrían aportar información valiosa.
Conclusiones- 1.
Una puntuación VExUS más alta se asocia a un mayor riesgo de resultados adversos, como rehospitalización y mortalidad por cualquier causa, en el plazo de un año. Esto pone de relieve el potencial de VExUS como marcador pronóstico en los pacientes con IC, aunque en nuestro análisis no se identificó como un factor predictivo independiente de los resultados.
- 2.
La incidencia de nefropatía congestiva en los pacientes ingresados por IC es elevada y se relaciona con la puntuación VExUS y una puntuación de congestión clínica mayor, y se relaciona con dosis más altas de diuréticos del asa.
- 3.
Los niveles de urea, el aumento del diámetro de la VCI y el sexo masculino fueron predictores independientes de malos resultados en la IC.
Este trabajo fue financiado parcialmente por el Departamento de Ciencia, Universidad y Sociedad del Conocimiento, del Gobierno de Aragón (España) (Grupos de Investigación B07_23R y T71_23D), también por el Proyecto PID2022-139143OA-I00 financiado por MICIU/AEI/10.13039/501100011033 y por FEDER/UE.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.