6 - RECEPTOR SOLUBLE DE TRANSFERRINA COMO MARCADOR DE DEFICIENCIA DE HIERRO TISULAR: IMPACTO EN BIOMARCADORES CARDÍACOS, SISTÉMICOS, HEMATÍNICOS Y NEUROHORMONALES EN PACIENTES CON INSUFICIENCIA CARDÍACA SIN DEFICIENCIA DE HIERRO SISTÉMICA
Hospital Universitari de Bellvitge, L'Hospitalet de Llobregat, España.
Objetivos: El receptor soluble de transferrina (sTfR) es un marcador del estado de hierro en los tejidos y puede ayudar a informar sobre la depleción leve de hierro y el aumento de la demanda de hierro a nivel tisular, incluso sin que se documente deficiencia de hierro sistémica o anemia manifiesta. Nuestro objetivo fue describir la asociación entre sTfR como marcador de aumento de la demanda de hierro y deficiencia de hierro tisular en biomarcadores cardíacos, sistémicos, neurohormonales y hematínicos en pacientes con IC, sin anemia y estado de hierro sistémico normal.
Métodos: Estudio observacional, prospectivo y de cohortes, con 1120 pacientes consecutivos con IC incluyendo todo el rango de FEVI (estudio DAMOCLES). Se incluyeron pacientes con niveles normales de hemoglobina (≥ 12 g/dL), estado de hierro sistémico normal (hierro sérico > 33 μg/dL, ferritina > 100 ng/mL y saturación de transferrina > 20%) y con biomarcadores disponibles. El objetivo principal fue explorar la asociación entre sTfR y los niveles de NT-proBNP. El objetivo secundario fue explorar la asociación entre sTfR y una amplia variedad de biomarcadores séricos.
Resultados: La cohorte final del estudio consistió en 215 pacientes. La edad media fue de 70 ± 12 años, la FEVI media fue de 43 ± 15% y 62 (29%) eran mujeres. El log[sTfR] (tabla) mostró correlaciones significativas con log[NT-proBNP] (r = 0,230; p = 0,001), log[cTnT] (r = 0,197; p = 0,028), log[albúmina(r = -0,221; p = 0,001), proteína C-reactiva (r = 0,215; p = 0,002), niveles séricos de eritropoyetina, MCH (r = -0,247; valor-p < 0,001) y MCHC (r = -0,209; p < 0,001). En modelos GAM (fig.1), se confirmó que niveles más altos de sTfR estaban asociados con niveles aumentados de biomarcadores sugiriendo daño cardíaco (cTnT, NT-proBNP), estado inflamatorio activo (proteína C-reactiva) y mayor estimulación celular en respuesta a la hipoxia tisular (eritropoyetina endógena).
|
Biomarcadores cardíacos y sistémicos |
||||||||
|
|
logNT-proBNP |
CRP |
logCTnT |
Log s-Albumin |
||||
|
|
sβc* |
p |
sβc* |
p |
sβc* |
p |
Sβc* |
p |
|
Log [sTfR 1 mg/L] |
0,186 |
0,004 |
0,199 |
0,004 |
0,178 |
0,049 |
-0,190 |
0,005 |
|
Biomarcadores neuro-hormonales |
||||||||
|
|
EPO |
sACE |
PRA |
ALDO |
||||
|
|
sβc* |
p |
sβc* |
p |
sβc* |
p |
sβc* |
p |
|
Log [sTfR 1 mg/L] |
-0,186 |
0,007 |
0,038 |
0,591 |
0,008 |
0,911 |
0,120 |
0,082 |
|
Biomarcadores hematínicos y estado de hierro |
||||||||
|
|
CHM |
MCHC |
RET-HEM |
TSAT |
||||
|
|
sβc* |
p |
sβc* |
p |
sβc* |
p |
sβc* |
p |
|
Log [sTfR 1 mg/L] |
-0,248 |
< 0,001 |
-0,187 |
0,019 |
-0,110 |
0,150 |
-0,086 |
0,215 |
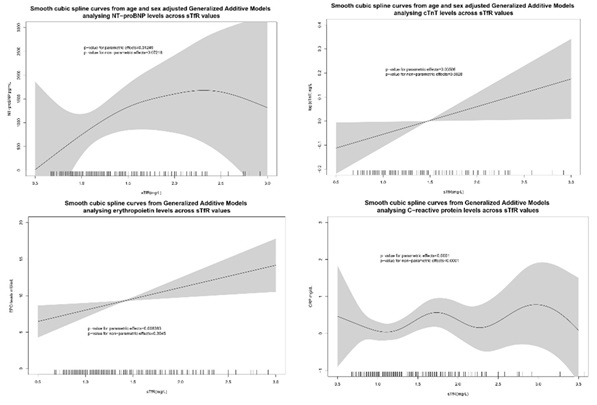
Conclusiones: En una cohorte de pacientes con insuficiencia cardíaca sin anemia ni deficiencia de hierro sistémica, niveles más altos de sTfR que indican una mayor demanda de hierro y déficit tisular de hierro, se asociaron con un peor perfil de biomarcadores que sugiere daño cardíaco y/o sistémico subclínico temprano, incluso en ausencia de deficiencia de hierro o anemia sistémica evidente.








