La evidencia reciente sugiere que la fragilidad puede ser un importante predictor de resultados adversos en personas mayores hospitalizadas por COVID-19. El objetivo de este estudio es determinar el valor pronóstico de la fragilidad en la supervivencia intrahospitalaria de estos pacientes.
MétodosEstudio observacional, multicéntrico y de ámbito nacional de pacientes ≥70 años hospitalizados a consecuencia de la COVID-19 en España desde el 1 de marzo hasta el 31 de diciembre de 2020. Los datos de los pacientes se obtuvieron del Registro SEMI-COVID-19 de la Sociedad Española de Medicina Interna. Se utilizó la escala de fragilidad Clínica (CFS, por sus siglas en inglés) para evaluar la fragilidad. El resultado primario fue la supervivencia hospitalaria. Se realizó un modelo de riesgos proporcionales de Cox para evaluar los predictores de supervivencia.
ResultadosSe incluyeron 1.878 participantes (52% varones y 48% mujeres). Mil trescientos cincuenta y un supervivientes (71,9%) y 527 no supervivientes (28,1%). El grupo de no supervivientes presentaba en comparación con los supervivientes una media de edad superior (83,5 frente a 81 años), más comorbilidades (6,3 frente a 5,3 puntos en el índice de Charlson), mayor grado de dependencia (26,8 frente al 12,4% de pacientes con dependencia severa) y de fragilidad (34,5 frente al 14,7% de pacientes con fragilidad severa), sin embargo, no hubo diferencias en cuanto al sexo. Nuestros resultados muestran que un grado de fragilidad moderado-grave es el principal factor asociado de forma independiente con una menor supervivencia (HR: 2,344; 1,437-3,823; p<0,001 para SFC 5-6 y HR: 3,694; 2,155-6,330; p<0,001 para SFC 7-9.
ConclusionesLa fragilidad es el principal predictor de resultados adversos en pacientes mayores con COVID-19. El uso de herramientas como la CFS es fundamental para la detección precoz de fragilidad en esta población.
Emerging evidence suggests that frailty may be a significant predictor of poor outcomes in older individuals hospitalized due to COVID-19. This study aims to determine the prognostic value of frailty on intrahospital patient survival.
MethodsThis observational, multicenter, nationwide study included patients aged 70 years and older who were hospitalized due to COVID-19 in Spain between March 1 and December 31, 2020. Patient data were obtained from the SEMI-COVID-19 Registry of the Spanish Society of Internal Medicine. Frailty was assessed using the Clinical Frailty Scale. The primary outcome was hospital survival. Cox proportional hazards models were used to assess predictors of survival.
ResultsA total of 1878 participants (52% men and 48% women) were included, with 1351 (71.9%) survivors and 527 (28.1%) non-survivors. The non-survivor group had higher mean age (83.5 vs. 81 years), comorbidities (6.3 vs. 5.3 points on the Charlson index), degree of dependency (26.8% vs. 12.4% severely dependent patients), and frailty (34.5% vs. 14.7% severely frail patients) compared to survivors. However, there were no differences in terms of sex. Our results demonstrate that a moderate–severe degree of frailty is the primary factor independently associated with shorter survival (HR 2.344; 1.437-3.823; p < 0.001 for CFS 5-6 and 3.694; 2.155–6.330; p < 0.001 for CFS 7-9).
ConclusionFrailty is the main predictor of adverse outcomes in older patients with COVID-19. The utilization of tools such as the Clinical Frailty Scale is crucial for early detection in this population.
La pandemia del COVID-19 ha tenido un enorme impacto en las personas mayores, que se encuentran entre los grupos más vulnerables y afectados. Esta población presenta una mayor proporción de casos severos y complicaciones durante la infección1, y muestra factores intrínsecos y extrínsecos que contribuyen a una mayor fragilidad clínica y a una mayor predisposición a procesos infecciosos, como por ejemplo un sistema inmunitario debilitado o inmunosenescencia2, comorbilidad más elevada3, desnutrición4 y una tasa de internamiento más alta.
Desde el comienzo de la pandemia del COVID-19, la edad avanzada se ha identificado como uno de los factores de riesgo más importantes en cuanto a complicaciones, resultados desfavorables y mortalidad5-7. La edad es un marcador pronóstico fácilmente evaluable; sin embargo, su utilidad pronóstica por sí sola es limitada8. En este sentido, la evidencia reciente indica que la fragilidad puede ser un importante factor predictivo de malos resultados en las personas mayores hospitalizadas por COVID-199,10. La fragilidad también se ha utilizado para la toma de decisiones clínicas durante esta pandemia11, pero aún se necesitan más investigaciones clínicas para determinar la utilidad del cribado de la fragilidad para predecir la enfermedad adversa.
La fragilidad se define como «un síndrome médico con múltiples causas y factores contribuyentes caracterizados por la disminución de fuerza, resistencia y función fisiológica, lo que aumenta la vulnerabilidad de una persona a desarrollar una mayor dependencia y/o a la muerte12. La probabilidad de fragilidad aumenta con la edad, y se calcula que afecta aproximadamente al 40% de los pacientes de edad avanzada13. Los criterios de fragilidad de Fried se utilizan de forma generalizada para diagnosticar la fragilidad14. Según estos criterios, se establece el diagnóstico de fragilidad si el paciente cumple 3 de los siguientes criterios: pérdida de peso involuntaria, agotamiento, debilidad muscular, lentitud motora o baja actividad. A lo largo de los años se han desarrollado múltiples instrumentos para evaluar la fragilidad, entre otros, escalas de detección rápida que son más viables en la práctica clínica y se aplican en solo unos minutos, como la escala clínica de fragilidad (CFS, por sus siglas en inglés)15 y la escala FRAIL16.
La relación entre el grado de fragilidad clínica antes de la infección y la progresión del COVID-19 ha sido objeto de varios estudios hasta la fecha. Sin embargo, la mayoría de los estudios que evalúan la capacidad pronóstica de la fragilidad clínica se han realizado en la población general o, en los casos en que sí evalúan factores pronósticos en pacientes de edad avanzada, no han incluido el grado de fragilidad. En este estudio se ha analizado la relación entre fragilidad y mortalidad, tasas de infección hospitalaria, tasas de ingreso en cuidados intensivos y fenotipos de la enfermedad10,17,18.
Otros factores como la edad avanzada, el sexo masculino, la dependencia funcional severa y las comorbilidades como la hipertensión, diabetes mellitus y la obesidad, así como los parámetros analíticos (proteína C-reactiva, linfopenia, neutrofilia, etc.), los parámetros clínicos en el momento del ingreso (hipoxia, puntuación SOFA alta, temperatura, etc.) y la presencia de anomalías radiológicas, también se han identificado como los principales factores de riesgo de una evolución desfavorable en las personas mayores con infección por COVID-1919-21.
La evaluación sistemática de la fragilidad en los pacientes mayores con infección por COVID-19 permite la identificación precoz de pacientes de edad avanzada frágiles. Esto permite una mejor asistencia de las personas con un mayor riesgo de enfermedad severa y facilita una mejor asignación de los recursos. Por consiguiente, los objetivos de este estudio en pacientes mayores hospitalizados por infección por COVID-19 son los siguientes: a) determinar el valor pronóstico de la fragilidad en la supervivencia intrahospitalaria en comparación con otros factores predictivos de un mal pronóstico identificados previamente y b) subrayar la importancia de la detección precoz de la fragilidad en esta población.
Materiales y métodosDiseño del estudio y población reclutadaPresentamos un estudio observacional, multicéntrico y de ámbito nacional de pacientes ≥70 años que fueron hospitalizados debido al COVID-19 en España entre el 1 de marzo y el 31 de diciembre de 2020. Los datos de los pacientes se obtuvieron gracias al Registro SEMI-COVID-19 de la Sociedad Española de Medicina Interna, que incluye 150 hospitales españoles. El registro engloba a todos los pacientes consecutivos ≥18 años ingresados en hospitales con COVID-19 confirmada por un análisis microbiológico mediante reacción en cadena de la polimerasa con retrotranscripción (RT-PCR) en muestras de frotis nasofaríngeo, muestras de esputo o lavado broncoalveolar. En este estudio nos hemos centrado en la subpoblación de pacientes ≥70 años.
Definición de las variablesEl Registro SEMI-COVID-19 recoge retrospectivamente datos del ingreso inicial de pacientes ≥18 años con COVID-19 confirmada. Los datos comprenden información sociodemográfica, antecedentes médicos previos, tratamientos habituales, cuadro clínico, situación clínica, resultados analíticos, hallazgos radiológicos, manejo clínico, complicaciones intrahospitalarias, duración de la estancia hospitalaria, reingresos precoces, derivación a centros de larga estancia o centros especializados de enfermería y muertes intrahospitalarias. Existe información más detallada sobre la justificación, los objetivos, la metodología y los resultados preliminares del Registro SEMI-COVID-19, publicada en esta revista en el volumen 220. número 822. Los médicos recopilaron los datos de forma retrospectiva mediante un sistema de captura electrónica de datos en línea.
Para evaluar el estado funcional antes del ingreso se utilizó el índice de Barthel. Una puntuación de 100-91 indica independencia o dependencia leve, de 90-61 indica dependencia moderada y ≤60 indica dependencia severa23. La carga de comorbilidad se evaluó mediante el índice de comorbilidad de Charlson (CCI, por sus siglas en inglés) ajustado respecto a la edad24. El diagnóstico de demencia se basó en los criterios del DSM-525. Las enfermedades cardiovasculares ateroscleróticas comprendían antecedentes de cardiopatía isquémica (infarto de miocardio, síndrome coronario agudo, angina o revascularización coronaria), enfermedad cerebrovascular (ictus, accidente isquémico transitorio) o arteriopatía periférica (claudicación intermitente, revascularización, amputación de extremidades inferiores o aneurisma de aorta abdominal). Las enfermedades cardiovasculares no ateroscleróticas eran fibrilación auricular e insuficiencia cardíaca. La obesidad se definió como un índice de masa corporal ≥30kg/m2. Se consideró que existía hipertensión, diabetes mellitus y dislipidemia si había un diagnóstico clínico previo o si el paciente había estado recibiendo tratamiento farmacológico para estos trastornos. La enfermedad pulmonar crónica se definió como un diagnóstico de enfermedad pulmonar obstructiva crónica y/o asma. Las neoplasias malignas incluían tumores sólidos y/o neoplasias hematológicas (excepto cáncer de piel distinto del melanoma). La enfermedad renal de moderada a grave se definió como una filtración glomerular estimada<45 ml/min/1,73m2 según la ecuación CKD-EPI26.
Los datos de comorbilidades antes del ingreso se obtuvieron de la historia clínica electrónica de cada paciente en cada hospital. En el momento del ingreso se recogieron los datos analíticos (gasometría, perfil metabólico, hemograma completo, coagulación) y pruebas de diagnóstico por la imagen.
Las variables de análisis se seleccionaron basándose en estudios recientes sobre la COVID-19 que las identificaron como indicadores de un mal pronóstico19-21. Estas variables fueron edad, sexo masculino, grado de dependencia severa (Barthel<60), diagnóstico clínico de enfermedad coronaria, diabetes e hipertensión; tabaquismo (previo o actual), saturación de oxígeno <90%, temperatura ≥37,8°C al ingreso y biomarcadores sanguíneos (lactato deshidrogenasa [LDH]: ≥500U/l, proteína C-reactiva [PCR]: ≥80mg/l, recuento de neutrófilos ≥7,5×103/μl y recuento de linfocitos<0,800×103/μl), así como infiltrados pulmonares bilaterales en la radiografía de tórax.
La fragilidad se evaluó mediante la CFS15. La evaluación se basó en el estado del paciente dos semanas antes del ingreso hospitalario. La CFS es una escala jerárquica ordinal que clasifica la fragilidad de 1 a 9, con una puntuación de 1 que indica «en forma», 2 «bien de salud», 3 «se maneja bien», 4 «vulnerable», 5 «fragilidad leve», 6 «fragilidad moderada», 7 «fragilidad severa», 8 «fragilidad muy severa» y 9 «enfermedad terminal». Debido a que el número de acontecimientos para cada puntuación era insuficiente, las puntuaciones se agruparon del siguiente modo para el análisis: 1-2 (en forma), 3-4 (volviéndose vulnerable, pero no frágil), 5-6 (signos iniciales de fragilidad, pero con cierto grado de independencia) y 7-9 (fragilidad severa o muy severa). Estos grupos se seleccionaron de modo que se ajustaran a las descripciones clínicas descritas en la CFS y se consideraron agrupamientos de severidad razonables para la fragilidad.
El criterio de valoración principal del estudio fue la supervivencia intrahospitalaria, que se definió como el tiempo transcurrido entre el ingreso hospitalario por COVID-19 y la muerte intrahospitalaria. En los pacientes diagnosticados de COVID-19 cuando ya estaban hospitalizados (infección hospitalaria o nosocomial), se utilizó la fecha del diagnóstico en lugar de la fecha del ingreso.
Análisis estadísticoLas variables cualitativas se presentaron en forma de frecuencias absolutas y relativas y se compararon mediante la prueba de Chi-cuadrado o la prueba exacta de Fisher, según procediera. Las variables cuantitativas se expresaron en forma de media y desviación estándar y se compararon mediante la prueba de la t de Student para grupos independientes.
Para evaluar el valor pronóstico de la fragilidad en la supervivencia de los pacientes, se realizó un análisis multivariante de riesgos proporcionales de Cox. En este análisis se incluyeron variables que mostraron una asociación significativa en el análisis univariante, así como otras variables de valor pronóstico reconocido y factores potencialmente de confusión descritos en la literatura, especialmente las encontradas en un artículo previo basado en este registro de pacientes con COVID-1919. Además, se generaron curvas de Kaplan-Meier para representar visualmente la supervivencia de los pacientes según las categorías de fragilidad. Y se asumió un nivel de significación de 0,05 (nivel de confianza del 95%). Los datos se almacenaron y analizaron mediante el paquete estadístico SPSS®, versión 25, para Windows.
Aspectos éticosSe obtuvo el consentimiento informado de todos los pacientes. En los casos en que había problemas de bioseguridad o se había dado al paciente de alta, se solicitó el consentimiento informado verbal y se documentó en la historia clínica. Se mantuvieron estrictamente la confidencialidad de los datos y el anonimato de los pacientes de conformidad con la normativa española que regula los estudios observacionales. La información identificable de los pacientes se eliminó antes de analizar la base de datos, asegurándose de que no se pudiera identificar a pacientes individuales ni en este artículo ni en la base de datos.
ResultadosSe identificó en el registro SEMI-COVID-19 a un total de 1.920 pacientes ≥70 años que habían sido hospitalizados debido a una infección por COVID-19 entre el 1 de marzo y el 31 de diciembre de 2020 y se evaluó su grado de fragilidad. Cuarenta y dos participantes fueron excluidos debido a que el registro de las características clínicas mínimas estaba incompleto. Finalmente, el estudio incluyó a 1.878 participantes de ambos sexos, un 52% de varones y un 48% de mujeres. De los pacientes incluidos, 1.351 (71,9%) fueron recibieron el alta hospitalaria con vida, mientras que 527 (28,1%) fallecieron durante su estancia hospitalaria. No hubo diferencias significativas en las tasas de supervivencia entre varones y mujeres (tabla 1).
Características clínicas y demográficas de los pacientes ≥70 años hospitalizados por COVID-19
| Variables | Todos los pacientes | Fallecidos | Vivos | Valor de p |
|---|---|---|---|---|
| (n=1.878) | (n=527) | (n=1.351) | ||
| Edad, años (media±desviación estándar) | 81,7±6,9 | 83,5±7,0 | 81,0±6,8 | <0,001 |
| Sexo (%) | 0,012 | |||
| Mujeres | 901 (48,0) | 228 (43,3) | 673 (49,8) | |
| Varones | 977 (52,0) | 299 (56,7) | 678 (50,2) | |
| IMC (media±desviación estándar) | 28,8±4,9 | 29,0±5,4 | 28,7±4,7 | 0,570 |
| Tabaquismo (%) | 581 (31,3) | 185 (35,7) | 396 (29,6) | 0,010 |
| Comorbilidades (%) | ||||
| Hipertensión arterial | 1.412 (75,2) | 412 (78,2) | 1.000 (74) | 0,061 |
| Dislipidemia | 974 (51,9) | 299 (56,7) | 288 (43,3) | 0,008 |
| Diabetes sin daño orgánico específico | 415 (22,1) | 108 (20,5) | 307 (22,7) | 0,295 |
| Diabetes con daño orgánico específico | 187 (10,0) | 75 (14,2) | 112 (8,3) | <0,001 |
| Fibrilación auricular | 395 (21,0) | 145 (27,5) | 250 (18,5) | <0,001 |
| Demencia | 390 (20,8) | 165 (31,3) | 225 (16,7) | <0,001 |
| Enfermedad neurológica degenerativa | 322 (17,2) | 127 (24,2) | 195 (14,4) | <0,001 |
| Insuficiencia cardíaca | 221 (11,8) | 100 (19,0) | 121 (9,0) | <0,001 |
| EPOC | 195 (10,4) | 65 (12,4) | 130 (9,6) | 0,082 |
| Insuficiencia renal crónica moderada-grave | 184 (9,8) | 86 (16,3) | 98 (7,3) | <0,001 |
| Infarto agudo de miocardio | 173 (9,2) | 78 (14,8) | 95 (7,0) | <0,001 |
| Vasculopatía periférica | 114 (6,1) | 41 (7,8) | 73 (5,4) | 0,054 |
| Asma | 113 (6,0) | 29 (5,5) | 84 (6,2) | 0,558 |
| Síndrome de apnea obstructiva del sueño | 104 (5,6) | 32 (6,1) | 72 (5,4) | 0,529 |
| Enfermedad cerebrovascular | 90 (4,8) | 40 (7,6) | 50 (3,7) | <0,001 |
| Neoplasia con metástasis | 38 (2,0) | 16 (3,0) | 22 (1,6) | 0,052 |
| Índice de Charlson (media±desviación estándar) | 5,6±2,0 | 6,3±2,2 | 5,2±1,9 | <0,001 |
| Grado de dependencia (%) | <0,001 | |||
| Leve | 1.171 (62,5) | 231 (43,9) | 940 (69,7) | |
| Moderado | 395 (21,1) | 154 (21,1) | 241 (17,9) | |
| Severo | 114 (16,4) | 141 (26,8) | 167 (12,4) | |
| CFS (%) | <0,001 | |||
| 1-2: en forma/bien de salud | 174 (9,3) | 20 (3,8) | 154 (11,4) | |
| 3-4: se maneja bien/vulnerable | 795 (42,3) | 145 (27,5) | 650 (48,1) | |
| 5-6: fragilidad leve/fragilidad moderada | 529 (28,2) | 180 (34,2) | 349 (25,8) | |
| 7-9: fragilidad severa/fragilidad muy severa/enfermedad terminal | 380 (20,2) | 182 (34,5) | 198 (14,7) |
Las variables se expresan en forma de media±desviación estándar (DE) con el valor de p.
CFS: escala clínica de fragilidad; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal.
Las características clínicas y demográficas de la población se muestran en la tabla 1. La edad media de la población era de 81,7±6,9 años, siendo mayor en el grupo de no supervivientes (83,5 frente a 81 años; p<0,001). Las comorbilidades más prevalentes eran hipertensión (75,2%), dislipidemia (51,9%), diabetes (32%), fibrilación auricular (21%) y demencia (20,8%). La proporción de comorbilidades como dislipidemia, diabetes mellitus con daño orgánico específico, fibrilación auricular, demencia, enfermedad neurológica degenerativa e insuficiencia cardiaca era significativamente mayor en el grupo de no supervivientes (p<0,001). Sin embargo, aunque la proporción de casos con hipertensión y EPOC también era mayor en el grupo de no supervivientes, no se observaron diferencias significativas en comparación con los supervivientes. El índice de Charlson era elevado en toda la población, pero mayor en el grupo de no supervivientes (6,3 frente a 5,3 puntos; p<0,001). La mayoría de los pacientes (62,5%) eran independientes o tenían un grado medio de dependencia; no obstante, la proporción de pacientes con un grado de dependencia moderado o severo era mayor entre los no supervivientes (34,2 frente al 25,8% de los pacientes con fragilidad moderada y 34,5 frente al 14,7% de los pacientes con fragilidad severa, respectivamente; p<0,001).
En cuanto al grado de fragilidad, 174 pacientes (9,3%) fueron clasificados en la categoría de «en forma/bien de salud» (CFS: 1-2); 795 pacientes (42,3%) en «vulnerables» (CFS: 3-4); 529 pacientes (28,9%) en «fragilidad moderada» (CFS: 5-6) y 380 pacientes (20,2%) en «fragilidad severa» o «enfermedad terminal» (CFS: 7-9). La proporción de pacientes con fragilidad moderada o severa es significativamente mayor en los no supervivientes (p<0,001)
Una mayor proporción de pacientes del grupo de no supervivientes tenía concentraciones significativamente más altas de leucocitos, neutrófilos, CRP, creatina, LDH, ferritina y procalcitonina (tabla 2) que los supervivientes (p<0,001). Los no supervivientes también presentaban linfopenia más intensa y mayores valores de dímero D, aunque esto no alcanzó significación estadística. La hipoxemia (saturación de oxígeno <90%) fue más frecuente en el grupo de no supervivientes (p<0,001). Los hallazgos radiológicos (condensaciones, infiltrados bilaterales y derrame pleural) fueron significativamente más frecuentes en el grupo de no supervivientes (p<0,001).
Hallazgos de laboratorio, de exploración física y radiológicos en pacientes ≥70 años hospitalizados por COVID-19
| Variables | Todos los pacientes | Fallecidos | Vivos | Valor de p |
|---|---|---|---|---|
| (n=1.878) | (n=527) | (n=1.351) | ||
| Temperatura, °C (media±desviación estándar) | 36,7±0,8 | 36,7±0,83 | 36,6±0,88 | 0,092 |
| Saturación de oxígeno <90% (media±desviación estándar) | 92,9±5,4 | 91,4±6,8 | 93,5±4,7 | <0,001 |
| Hallazgos en la radiografía de tórax (%) | ||||
| Condensación pulmonar | <0,001 | |||
| Unilateral | 172 (10,6) | 51 (12,2) | 121 (10,1) | |
| Bilateral | 312 (19,3) | 134 (32,1) | 178 (14,8) | |
| Infiltrados pulmonares intersticiales | <0,001 | |||
| Unilateral | 126 (7,8) | 23 (5,5) | 103 (8,6) | |
| Bilateral | 969 (59,9) | 299 (71,7) | 670 (55,8) | |
| Derrame pleural | <0,001 | |||
| Unilateral | 56 (3,5) | 27 (6,5) | 29 (2,4) | |
| Bilateral | 32 (2,0) | 16 (3,8) | 16 (1,3) | |
| Analítica, (media±desviación estándar) | ||||
| Hemoglobina, g/dl | 12,7±2,0 | 12,4±2,2 | 12,8±2,0 | <0,001 |
| Leucocitos, 103/μl | 7.665,3±4.929,8 | 8.871±6.708 | 7.196±3.938 | <0,001 |
| Neutrófilos, 103/μl | 5.901,8±4.333,5 | 7.038±3.888,4 | 5.460±5.144,0 | <0,001 |
| Linfocitos, 103/μl | 1.169,9±2.657,6 | 1.094,3±2.729,9 | 1.099,1±2.629,5 | 0,444 |
| Plaquetas, 103/μl | 200±90 | 197±91 | 202±89 | 0,244 |
| Proteína C-reactiva, mg/l | 90,1±85,6 | 115,7±101,2 | 80,9±76,6 | <0,001 |
| Creatinina, mg/dl | 1,3±1,0 | 1,6±1,2 | 1,2±0,9 | <0,001 |
| LDH, U/l | 357,5±230,2 | 407,4±302,7 | 338,7±193,0 | <0,001 |
| Ferritina, μg/l | 748,2±890,5 | 996,7±1197,8 | 663,5±739,8 | <0,001 |
| Albúmina, g/dl | 3,4±3,5 | 3,2±0,5 | 3,5±−0,5 | <0,001 |
| Procalcitonina, ng/ml | 0,54±2,77 | 0,93±3,6 | 0,39±2,3 | 0,014 |
| Dímero D, ng/ml | 2.376,9±14.956,5 | 3.749,9±2.7261,2 | 1.869,4±5.584,4 | 0,145 |
Las variables se expresan en forma de media±desviación estándar (DE) con el valor de p.
LDH: lactato deshidrogenasa.
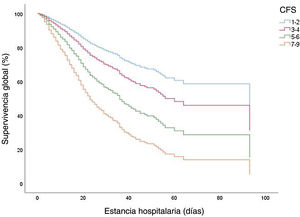
La fragilidad se asoció a una mayor mortalidad global tras el ajuste respecto a la edad, el sexo y las comorbilidades, de modo que se observó un empeoramiento del desenlace clínico con una mayor fragilidad (tabla 3 y fig. 1). El hazard ratio (HR) bruto del tiempo transcurrido desde el ingreso hospitalario hasta la mortalidad fue de 1,634, IC del 95%: 1,023-2,611; p 0,04 para CFS: 3-4; HR: 2,887; IC del 95%: 1,816-4,591; p<0,001 para CFS: 5-6 y HR: 5,557; IC del 95%: 3,493-8,841; p<0,001 para CFS 7-9, todos en comparación con CFS: 1-2. El HR ajustado fue de 1,458; IC del 95%: 0,903-2,355; p 0,001 para CFS: 3-4; 2,344; IC del 95%: 1,437-3,823; p<0,001 para CFS: 5-6 y 3,694; IC del 95%: 2,155-6,330; p<0,001 para CFS: 7-9. La PCR elevada, la linfopenia, la neutrofilia, la hipoxemia y los infiltrados bilaterales en la radiografía de tórax también se asociaron significativamente con la mortalidad (p<0,001). La dependencia severa también se asoció de forma significativa con la mortalidad en el análisis univariante con un HR bruto de 2,409; IC del 95%: 1,984-2,926; p<0,001; sin embargo, en el análisis multivariante esta asociación no fue significativa; HR ajustado: 1,184; IC del 95%: 0,879-1,595; p 0,266.
Factores pronósticos de supervivencia intrahospitalaria. Análisis uni y multivariante
| Variables | Univariante | Multivariante | ||||
|---|---|---|---|---|---|---|
| HR | IC 95% | Valor de p | HR | IC 95% | Valor de p | |
| CFS 1-2 | Referencia | |||||
| CFS 3-4 | 1,634 | 1,023-2,611 | 0,040 | 1,458 | 0,903-2,355 | 0,123 |
| CFS 5-6 | 2,887 | 1,816-4,591 | <0,001 | 2,344 | 1,437-3,823 | <0,001 |
| CFS 7-9 | 5,557 | 3,493-8,841 | <0,001 | 3,694 | 2,155-6,330 | <0,001 |
| Proteína C-reactiva ≥80mg/l | 2,196 | 1,844-2,613 | <0,001 | 1,835 | 1,530-2,201 | <0,001 |
| Linfocitos<0,800×103/μl | 1,829 | 1,537-2,175 | <0,001 | 1,706 | 1,418-2,051 | <0,001 |
| Neutrófilos ≥7,5×103/μl | 1,676 | 1.412.990 | <0,001 | 1,503 | 1,256-1,799 | <0,001 |
| SatO2<90% | 1,665 | 1,371-2,020 | <0,001 | 1,492 | 1,218-1,827 | <0,001 |
| Infiltrados pulmonares intersticiales bilaterales en la radiografía | 1,559 | 1,255-1,936 | <0,001 | 1,375 | 1,092-1,732 | 0,007 |
| Dependencia severa | 2,409 | 1,984-2,926 | <0,001 | 1,184 | 0,879-1,595 | 0,266 |
| Índice de Charlson | 1,154 | 1,115-1,194 | <0,001 | 1,067 | 1,023-1,113 | 0,003 |
| Edad, años | 1,057 | 1,044-1,070 | <0,001 | 1,032 | 1,018-1,047 | 0,000 |
| Sexo femenino | 1,119 | 0,857-1,212 | 0,828 | 0,989 | 0,821-1,191 | 0,906 |
CFS: escala clínica de fragilidad; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; SatO2: saturación de oxígeno.
Nuestro estudio determina la importancia de la detección precoz de la fragilidad en pacientes mayores hospitalizados por COVID-19, considerándolo como el principal factor de riesgo asociado a resultados adversos en comparación con otros factores de riesgo ya identificados en estudios anteriores. Los principales factores predictivos de un mal pronóstico durante la fase aguda de la infección se han descrito en estudios anteriores. Sin embargo, la mayoría de ellos se han realizado en la población general y solo en algunos se han centrado en la población de pacientes mayores o han evaluado el grado de fragilidad17.
La edad avanzada se asocia a una mayor mortalidad, pero no es suficiente por sí sola para estratificar el riesgo en pacientes con COVID-19 y es objeto de controversia ética11. El estado funcional antes del ingreso desempeña un papel importante en la evolución de los pacientes de este perfil, especialmente en aquellos con un grado de fragilidad moderado-grave que tienen un mayor riesgo de resultados adversos. Esta relación entre fragilidad y aumento de la mortalidad se ha estudiado a fondo en otras enfermedades. En la COVID-19, un número cada vez mayor de estudios han identificado la fragilidad como uno de los principales factores pronósticos de la enfermedad, pero aún se necesitan más evidencias.
Anteriormente, el Registro SEMI-COVID19 había identificado los principales factores predictivos de un mal pronóstico en pacientes de edad muy avanzada (>80 años) hospitalizados debido a una infección por COVID-19 y este estudio fue el primero en identificar la importancia pronóstica del estado clínico antes del ingreso para el resultado de pacientes geriátricos, observándose que un grado severo de dependencia (definido como un índice de Barthel ≤60) era un factor predictivo independiente de mortalidad. No obstante, una de las principales limitaciones de este estudio fue que no evaluó la fragilidad. La edad avanzada, el grado severo de dependencia, el sexo masculino y determinadas anomalías de laboratorio y en la radiografía de tórax fueron los principales factores predictivos de un resultado clínico adverso en esta población. Por el contrario, las comorbilidades no se asociaron a una mayor mortalidad. Nuestros datos muestran concordancia con los resultados de este estudio, salvo en algunos aspectos. No se encontró asociación entre la supervivencia intrahospitalaria y el sexo o el grado severo de dependencia. Sin embargo, un alto grado de comorbilidad (definida por un índice de Charlson ≥4) se asoció a una menor supervivencia intrahospitalaria.
Los estudios que evaluaron la fragilidad en la COVID-19, como el estudio COPE17 y otros27, demostraron que la fragilidad se asociaba a mortalidad y a una estancia hospitalaria más prolongada, lo que demuestra que el resultado clínico empeora con una mayor fragilidad. Nuestros resultados no solo confirman estas afirmaciones, sino que también establecen que la presencia de fragilidad moderada-grave es el principal factor pronóstico asociado de forma independiente a la supervivencia hospitalaria global en comparación con los otros factores identificados en estudios previos. Además, existe una relación directa entre un mayor grado de fragilidad y una menor supervivencia intrahospitalaria.
La valoración del grado de fragilidad se realizó con el método cuantitativo CFS, que es el más utilizado en otros estudios28,29. La CFS es un instrumento de cribado fiable y potencialmente útil para identificar la fragilidad. También es fácilmente aplicable, incluso en una situación de recursos humanos limitados y una demanda creciente de servicios médicos30, como ocurrió en la pandemia de COVID-19. Se dispone de otras determinaciones de la fragilidad para evaluar la fragilidad en pacientes hospitalizados, pero lleva mucho más tiempo aplicarlas o se basan en datos recopilados sistemáticamente para puntuar la fragilidad31. El National Institute for Health and Care Excellence (NICE) publicó en 2020 las guías rápidas para la asistencia crítica de adultos en la COVID-19, en las que se recomienda el uso de la CFS en pacientes de 65 años o más para facilitar la toma de decisiones clínicas y evitar la discriminación por la edad32.
Por consiguiente, la evaluación precoz de la fragilidad representa una valiosa oportunidad para prestar una asistencia de mayor calidad a los adultos mayores con COVID-19. La detección precoz y el seguimiento meticuloso de la fragilidad pueden alertarnos de la posibilidad de resultados adversos y ayudarnos a proporcionar un tratamiento clínico adecuado en este perfil de pacientes. El abordaje inicial de estos pacientes debe incorporar una evaluación funcional adecuada que incluya la evaluación del grado de fragilidad. Además, queremos resaltar la importancia del uso de la escala CFS como predictor de episodios desfavorables en esta población.
Este estudio tiene algunas limitaciones. En primer lugar, se trata de una serie retrospectiva centrada en pacientes hospitalizados. Dado que estos pacientes tenían una enfermedad más grave y una tasa de mortalidad más alta, nuestros datos podrían sobrestimar la mortalidad global en la totalidad de los adultos mayores de 70 años con COVID-19. En segundo lugar, al tratarse de un estudio de cohortes retrospectivo, los datos fueron recogidos por un gran número de investigadores, lo que podría haber dado lugar a heterogeneidad en la introducción y validación de los datos.
ConclusionesEn pacientes mayores hospitalizados debido a una infección por COVID-19, el grado de fragilidad es el principal factor predictivo de la supervivencia intrahospitalaria, y se ha demostrado que aumenta el riesgo de mortalidad global después de ajustar respecto a la edad, las comorbilidades y otros factores pronósticos relacionados con la gravedad de la infección. Estos hallazgos ponen de relieve la necesidad de una detección precoz de la fragilidad mediante escalas clínicas, ya que es de vital importancia para establecer un pronóstico en esta población.
FinanciaciónLos autores declaran que no han recibido financiación para realizar este estudio.
AutoríasEl Dr. Ricardo Gómez Huelgas y el Dr. José Manuel Ramos Rincón han contribuido por igual a este trabajo y comparten la autoría final.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Declaración sobre los datos disponiblesLos conjuntos de datos generados durante el presente estudio no están disponibles públicamente debido a restricciones éticas o de privacidad, pero se pueden solicitar por motivos razonables a la autora para el envío de correspondencia.
Queremos agradecer a Doña Claudia Corazza González su ayuda con la versión final en inglés.
Almudena López Sampalo1 MD; Halbert Hernández Negrín1 MD; María Rosa Bernal López1,2 PhD; Manuel Rubio Rivas3 MD, PhD; María Dolores Martín Escalante4 MD, PhD; Philip Wikman Jogersen5 MD, PhD; Ana García Reyne6 MD; Rosa Fernández Madera Martínez7 MD; María Gómez Antúnez8 MD; José Luis Beato Pérez9 MD; José David Torres Peña10 MD, PhD; José Ángel Martín Oterino11 MD; José Loureiro Amigo12 PhD; Juan Vicente de la Sota13 MD; Ricardo Gil Sánchez14 MD; Manuel Lorenzo López Reboiro15 MD; Berta Bernal Román16 MD; Joaquín Fernández Sola17 MD; Francisco Amorós Martínez18 MD; Natalia Vicente López19 MD; Reina Valle Bernard20 MD; Antonio López Ruiz21 MD; José Manuel Ramos Rincón22 MD PhD y Ricardo Gómez Huelgas1,2 MD PhD.
1. Servicio de Medicina Interna, Hospital Universitario Regional de Málaga, Instituto de Investigación Biomédica de Málaga (IBIMA- Plataforma BIONAND), Universidad de Málaga (UMA), Málaga, España
2. Centro de Investigación Biomédica en Red Fisiopatología de la Obesidad y Nutrición (CIBERobn), Instituto de Salud Carlos III, Madrid, España
3. Servicio de Medicina Interna, Hospital Universitario de Bellvitge, Instituto de Investigación Biomédica de Bellvitge-IDIBELL, Universidad de Barcelona, Barcelona, España
4. Servicio de Medicina Interna, Hospital Costa del Sol, Marbella, Málaga, España
5. Servicio de Medicina Interna, Hospital Universitario San Juan, Alicante, España
6. Servicio de Medicina Interna, Hospital Universitario 12 de Octubre, Madrid, España
7. Servicio de Medicina Interna, Hospital Universitario de Cabueñes, Gijón, España
8. Servicio de Medicina Interna, Hospital Universitario Gregorio Marañón, Madrid, España
9. Servicio de Medicina Interna, Complejo Hospitalario Universitario de Albacete, Albacete, España
10. Servicio de Medicina Interna, Hospital Universitario Reina Sofia, Córdoba, España
11. Servicio de Medicina Interna, Complejo Asistencial Universitario de Salamanca, Salamanca, España
12. Servicio de Medicina Interna, Hospital Moisès Broggi, Sant Joan Despí, Barcelona, España
13. Servicio de Medicina Interna, Hospital Universitario Infanta Cristina, Parla, Madrid, España
14. Servicio de Medicina Interna, Hospital Universitario La Fe, Valencia, España
15. Servicio de Medicina Interna, Hospital Regional de Monforte de Lemos, Monforte de Lemos, Lugo, España
16. Servicio de Neumología, Hospital Universitario Doctor José Molina Orosa, Arrecife, Lanzarote, España
17. Servicio de Medicina Interna, Hospital Clínic, Barcelona, España
18. Servicio de Medicina Interna, Hospital del Vinalopó, Alicante, España
19. Servicio de Medicina Interna, Hospital Universitario del Sureste, Arganda del Rey, Madrid, España
20. Servicio de Medicina Interna, Hospital Sierrallana, Torrelavega, Cantabria, España
21. Servicio de Medicina Interna, Hospital de la Axarquía, Vélez-Málaga, Málaga, España
22. Servicio de Medicina Clínica, Universidad Miguel Hernández de Elche, Alicante, España