La anemia es una de las comorbilidades más frecuentes en los pacientes con insuficiencia cardiaca crónica descompensada que ingresan en los servicios de Medicina Interna. Sin embargo, aunque existen evidencias que avalan su corrección para mejorar la capacidad funcional de estos pacientes y reducir su tasa de reingreso, las guías de práctica clínica no dan directrices sobre su abordaje. Constituye un problema clínico idóneo para el internista por su origen multifactorial y la visión integradora necesaria para abordar la conjunción de síndromes que se dan en estos pacientes (anemia, insuficiencia cardiaca, síndromes geriátricos, diabetes…). La elección de la estrategia de tratamiento en el caso de decidir hacerlo, debe iniciarse tras corregir los signos congestivos en el paciente ambulatorio con tratamiento óptimo de la insuficiencia cardiaca.
Anemia is one of the most common comorbidities in patients with decompensated chronic heart failure admitted to the Internal Medicine Ward. However, although there is evidence supporting its treatment to improve the functional capacity of the patients and to reduce the new admissions rate, the clinical practice guidelines do not provide any directives regarding its approach. This is an ideal clinical problem for the internist due to its multifactorial origin and the comprehensive point of view needed to approach the group of syndromes that occur in these patients (anemia, heart failure, geriatric syndromes, diabetes, etc.) The choice of treatment strategy, if such treatment is decided, should always begin after correcting the congestive signs in the outpatient with optimal treatment of heart failure.
Mujer de 85 años con diabetes mellitus tipo 2 e hipertensión de 15 años de evolución, accidente cerebro-vascular hacía 5 años sin déficit motor posterior. Hemorragia digestiva baja 4 años antes, que precisó transfusión sin encontrar causa del sangrado. Dos años antes fue ingresada en un centro hospitalario por angor secundario a flutter auricular revertido farmacológicamente. Posteriormente, presentó hipotiroidismo subclínico y deterioro de la función renal con cifras de creatinina siempre alrededor de 1,7mg/dl junto con cifras de hemoglobina (Hb) de 10,2g/dl con patrón sugestivo de anemia de enfermedad crónica. En los dos meses previos a la consulta actual ingresa en tres ocasiones en la Unidad de Corta Estancia por insuficiencia cardiaca (IC) observándose una caída progresiva de la Hb hasta los 7,5g/dl, por lo que se transfundió un concentrado de hematíes. En el ecocardiograma se evidenció disfunción diastólica con cavidades izquierdas no dilatadas, sin alteraciones segmentarias de la contractibilidad y una fracción de eyección del ventrículo izquierdo (FEVI) del 63%, insuficiencias aórtica y mitral leves. Tres muestras separadas de heces habían sido negativas para sangre oculta. En la consulta está abatida, refiere disnea a mínimos esfuerzos y ortopnea, por lo que ya no sale de casa nunca. A la exploración las constantes son normales, se observan discretos edemas maleolares sin otros signos congestivos, se aprecian subcrepitantes en ambas bases pulmonares y en la auscultación cardiaca hay un soplo sistólico 1/6 en mesocardio y foco aórtico. En los análisis destaca: Hb 9,1g/dl; hematocrito 27,9%; volumen corpuscular medio (VCM) 84,8 fl; creatinina 2,4mg/dl; sideremia 67 mcg/dl; ferritina 67,48 ng/ml (n=15-150); eritropoyetina (EPO) 7,71 mU/ml (n=5-25,2). El resto de las determinaciones incluidas vitamina B12 y ácido fólico eran normales ¿Qué actitud terapéutica debe realizarse con esta paciente?
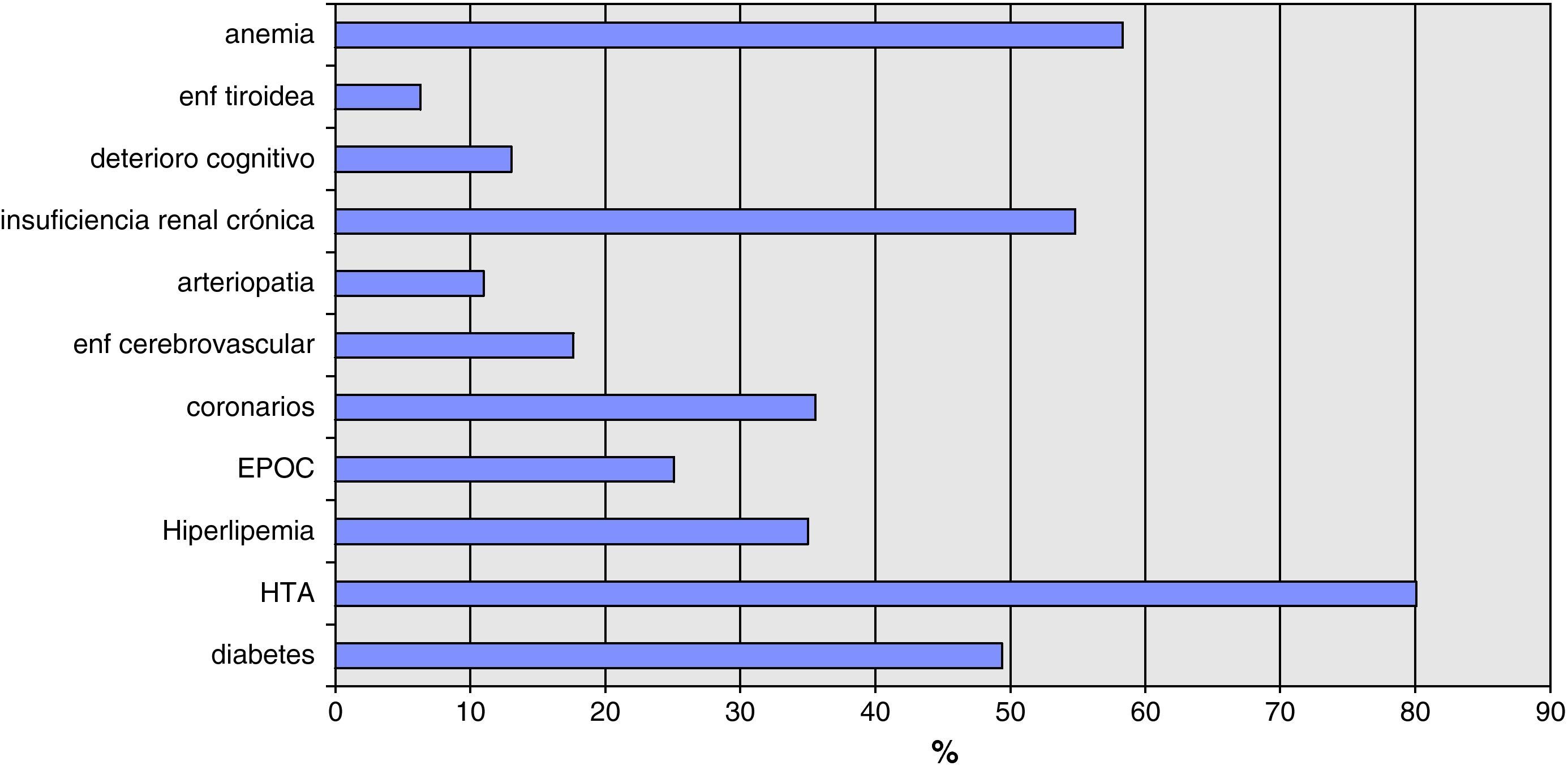
El problema clínicoEn los últimos años, ha ido aumentando el interés sobre la importancia de un correcto manejo de las comorbilidades asociadas en los pacientes con IC. Entre ellas, la anemia siempre se ha considerado una causa no infrecuente de descompensación1 debido a la repercusión de la capacidad de transporte de O2 del paciente en las manifestaciones clínicas del fallo cardiaco. Es, junto con la insuficiencia renal crónica, la comorbilidad más frecuente en los pacientes ingresados en Medicina Interna (MI) por insuficiencia cardiaca, superando a la diabetes (fig. 1). Sin embargo, es muy escasa la información de las guías de práctica clínica actuales sobre su abordaje y manejo.
Comorbilidad en pacientes con IC registrada en el estudio GESAIC. Fuente: tomado de NKF-DOQI2.
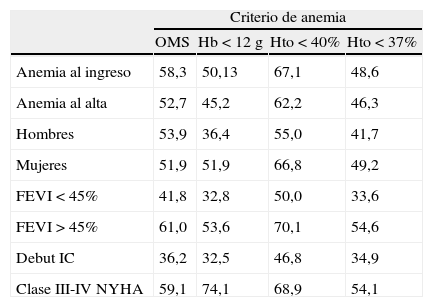
La definición más utilizada en los estudios es la de la Organización Mundial de la Salud (OMS) (Hb mayor a 13g/dl en varones o 12g/dl en mujeres), aunque también encontramos a menudo un valor de Hb mayor a 12g/dl para ambos sexos, inicialmente empleada por nefrólogos en los estudios de la anemia asociada a la insuficiencia renal2; en otros estudios se ha definido la anemia con valores distintos del hematocrito. Esta variabilidad en la definición es uno de los factores cruciales para explicar el amplio abanico en las tasas de prevalencia encontradas en los distintos estudios. Otro factor que explica esta variabilidad son las diferencias en las cohortes estudiadas (tabla 1)3. La prevalencia aumenta claramente con el tiempo de evolución de la IC, la edad y el deterioro de la función renal. Existen dudas sobre si se encuentra la misma prevalencia en IC con FEVI deprimida o preservada. Si bien en nuestra experiencia es más prevalente con FEVI preservada, metanálisis recientes mostraban tasas similares para ambas situaciones4. Existen pocos estudios de incidencia y, además, la mayor parte de la información proviene de ensayos clínicos, lo que supone un sesgo de selección de pacientes al no incluir individuos de edad avanzada o con insuficiencia renal grave. Por los datos de que disponemos, la incidencia anual de anemia en la IC se halla entre el 10 y el 20%5–8; observándose una expresividad fluctuante que puede desaparecer en el seguimiento del paciente sin haber actuado aparentemente sobre ella, y que condiciona diferencias pronósticas entre los sujetos con anemia persistente o corregida.
Variabilidad en la prevalencia de anemia según escenario y criterio de definición (valores expresados en %)
| Criterio de anemia | ||||
| OMS | Hb<12 g | Hto<40% | Hto<37% | |
| Anemia al ingreso | 58,3 | 50,13 | 67,1 | 48,6 |
| Anemia al alta | 52,7 | 45,2 | 62,2 | 46,3 |
| Hombres | 53,9 | 36,4 | 55,0 | 41,7 |
| Mujeres | 51,9 | 51,9 | 66,8 | 49,2 |
| FEVI<45% | 41,8 | 32,8 | 50,0 | 33,6 |
| FEVI>45% | 61,0 | 53,6 | 70,1 | 54,6 |
| Debut IC | 36,2 | 32,5 | 46,8 | 34,9 |
| Clase III-IV NYHA | 59,1 | 74,1 | 68,9 | 54,1 |
FEVI: fracción de eyección ventricular izquierda; Hb: hemoglobina; Hto: hematocrito; IC: insuficiencia cardiaca; NYHA: New York Heart Association; OMS: Organización Mundial de la Salud.
Fuente: Estudio GESAIC (tomado de NKF-DOQI2).
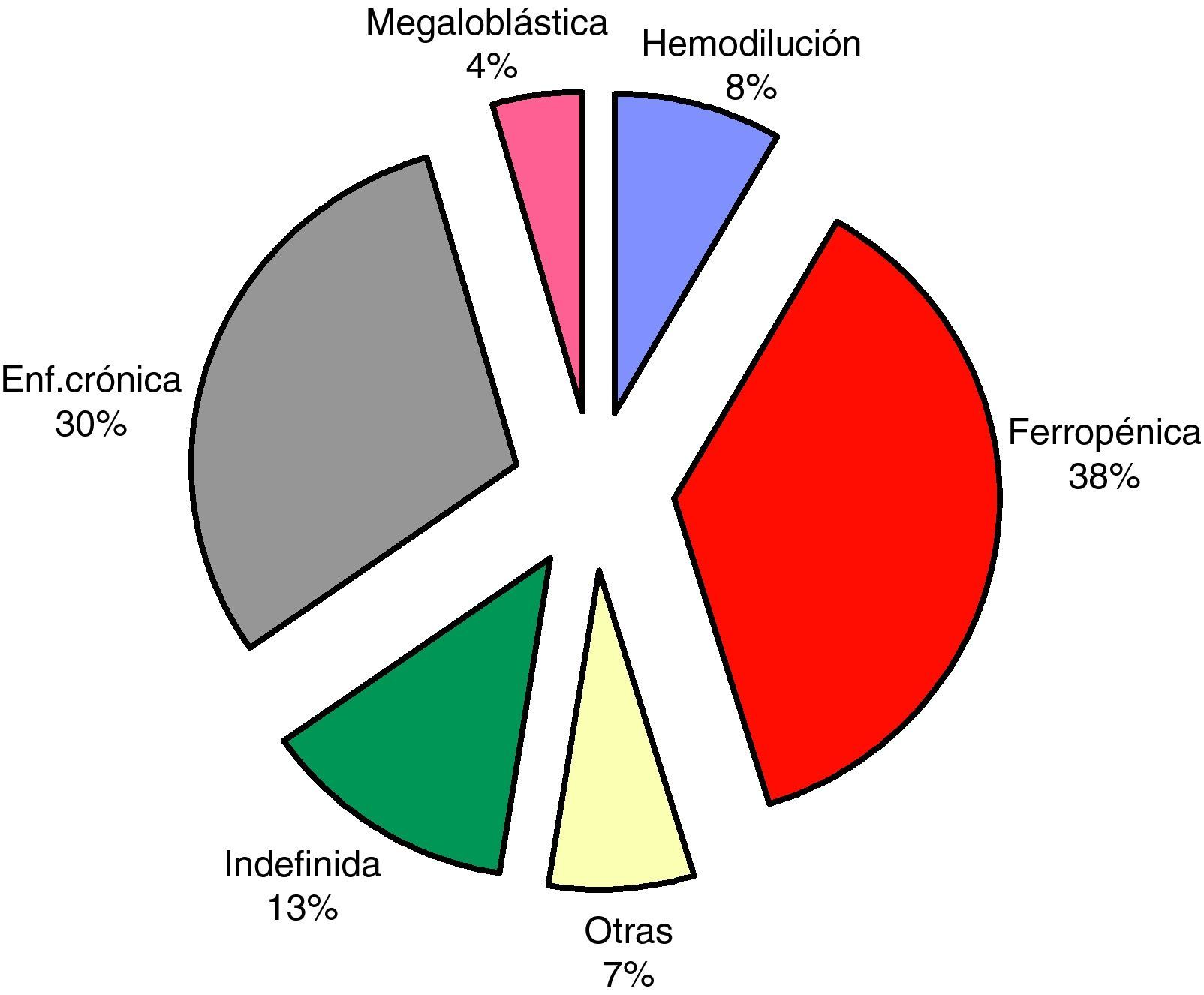
En el paciente con IC se presentan varias circunstancias que pueden conducir al desarrollo y mantenimiento de anemia. En primer lugar, existe un estado de hemodilución y por lo tanto de falsa anemia que en el estadio IV de la New York Heart Association (NYHA) puede representar el factor más determinante de los valores bajos de hematocrito9. El déficit de hierro (Fe) es otro factor importante, alguna serie ha llegado a suponer hasta el 73% de los casos10. A ello contribuye el deterioro del estado general con anorexia asociada, la llamada caquexia cardiaca, con deficiencias nutricionales de Fe, folato o vitamina B12, acentuadas por malabsorción secundaria a edema de la mucosa gastrointestinal. Además, fármacos de uso común, si no obligado en estos pacientes, favorecen la aparición o agravamiento de la anemia. Tal es el caso de anticoagulantes y antiagregantes que causan pérdidas hemáticas, o de los inhibidores de la enzima convertidora de angiotensina (IECA) que interfieren en la regulación de la EPO. La EPO es una hormona glicoproteica que inhibe la apoptosis de las células madre hematopoyéticas y es producida por las células peritubulares del córtex renal en respuesta a la hipoxia11. En la IC la disminución del flujo renal y la hipoxia tisular estimula indirectamente la producción de EPO; además, los niveles elevados de angiotensina II estimulan la proliferación de las células progenitoras eritroides a través del receptor de la angiotensina tipo 1. Este doble mecanismo explica que en la IC encontremos niveles de EPO normales o aumentados, según los márgenes de referencia del laboratorio de análisis clínicos; cuando, en realidad, están por debajo de los valores esperados para la concentración de Hb del paciente12. La hipótesis más aceptada actualmente para explicar este fenómeno es la combinación de una inhibición en la producción de EPO y un estado inflamatorio subyacente. Así, la activación de la interleucina-1 (IL-1) y del factor de necrosis tumoral alfa (TNF-α) existente en estos pacientes produce un bloqueo en la liberación del Fe tisular; a la vez, hay una menor absorción intestinal del Fe debido al aumento en la producción de hepcidina secundaria a niveles altos de IL-6. Todos estos factores estarían sobreexpresados al coincidir en el paciente una insuficiencia renal crónica junto con una deficiencia de síntesis y una resistencia a la EPO13. Este atractivo mecanismo de producción y perpetuación de la anemia en la IC es aplicable a un 40% de los casos de anemia e IC que ingresan en los servicios de MI y muestran un patrón de anemia de enfermedad crónica, incluyendo en esta categoría a un 13% de pacientes sin otra enfermedad crónica que la propia IC14 (fig. 2).
Etiología de la anemia en pacientes con IC. Estudio GESAIC. Fuente: tomado de Grau-Amorós J et al14.
Aunque la mayoría de estudios señalan la anemia en la IC como factor independiente para mortalidad, también existen trabajos bien diseñados donde la anemia no es un factor pronóstico independiente. Por lo tanto, la controversia sobre si la anemia es un factor de riesgo o un marcador asociado a los auténticos factores de riesgo se mantiene, ya que como hemos comentado antes, su prevalencia aumenta al coincidir con otras variables clínicas que son clásicos factores de riesgo de mortalidad. En seguimientos inferiores a los 18 meses la relación entre anemia y mortalidad es mucho menos consistente y si solo consideramos cohortes formadas con el debut de IC, la anemia tampoco confiere carácter pronóstico. Un metanálisis reciente concluye15 que el riesgo absoluto para mortalidad de los pacientes con anemia es de 1,96 independientemente de la FEVI preservada o disminuida. Sin embargo, engloba todos los estudios sin considerar las diferencias en el criterio definitorio de anemia entre ellos. Otros trabajos publicados sí coinciden en señalar la anemia como factor de riesgo independiente para reingreso16 y en su repercusión negativa en la calidad de vida percibida por el paciente17.
Resulta interesante la aportación de los estudios que examinan la anemia a lo largo del seguimiento. Constatan que la anemia es un factor de riesgo siempre y cuando perdure a lo largo del tiempo18, careciendo de significado su desaparición. Parece lógico que así sea y, probablemente, refleja la diferencia pronóstica de los pacientes con anemia por hemodilución que consiguen un control óptimo de su volemia más aquellos con déficit de Fe que se corrige con facilidad; mientras que aquellos pacientes con anemia asociada a enfermedad crónica, fundamentalmente insuficiencia renal crónica, tienen un marcado peor pronóstico19. De hecho, la mayoría de estudios en que la anemia es marcador pronóstico para mortalidad y/o reingreso, están formados por cohortes de IC con FEVI deprimida de los que se excluyeron pacientes con ferritina o saturación de transferrina bajas, una situación que aunque no se acompañe de anemia, si se considera como factor de mal pronóstico20.
Actualmente, continúa el debate sobre si la anemia es un mediador o un marcador de mal pronóstico y, además, los mecanismos etiopatogénicos no están completamente esclarecidos.
Tratamiento de la anemia en la insuficiencia cardiacaEn los pacientes con IC, la anemia es un factor que empeora el trabajo cardíaco y la captación tisular de O2. Por ello, parece lógico su tratamiento con el objetivo de mejorar la morbimortalidad. Las escasas evidencias de que disponemos sobre el uso de transfusiones de hematíes en estos pacientes desaconsejan por el momento su uso salvo en situación de inestabilidad hemodinámica21.
Sin duda, el primer paso consiste en optimizar al máximo el tratamiento de la IC y haber corregido los signos congestivos para obviar la falsa anemia por hemodilución y, por supuesto, haber descartado causas corregibles de anemia, fundamentalmente la ferropenia y tratarla si existe. No es el motivo de este trabajo desarrollar un protocolo de estudio de la anemia en general; nos centraremos en aquel paciente en el que ya se han realizado estos pasos previos y nos planteamos la conveniencia de tratar la anemia. Hasta hace poco, los estudios que examinanban el beneficio del tratamiento con Fe mostraban resultados discutibles. Sin embargo, recientemente, se han reportado los resultados del mayor estudio con Fe endovenoso realizado en pacientes con IC y, aunque los valores absolutos conseguidos parecen modestos, la mejoría en la calidad de vida percibida y el incremento en la capacidad al esfuerzo medida con el test de la marcha a los 6 minutos, recomiendan la ferroterapia si el paciente presenta ferritina o índice de saturación de la transferrina bajas. A destacar que incluso pacientes con niveles de Hb normales presentaban mejoría de los objetivos secundarios del estudio22, probablemente porque en ellos existía una deficiencia subclínica de Fe. Si es posible, la vía de elección para el tratamiento con Fe es la oral, aunque en muchas ocasiones no resulta eficaz por el déficit de absorción, interacción con los inhibidores de la bomba de protones23 o por pérdidas silentes de hierro; en estas situaciones la reposición férrica por vía endovenosa es la solución.
Si no tenemos evidencia de déficit de Fe y en el paciente coexiste una insuficiencia renal crónica iniciaremos tratamiento a dosis progresivas con EPO teniendo en cuenta el resultado de los últimos estudios CHOIR, CREATE y TREAT24–26 en pacientes con IRC en prediálisis. Un metanálisis estimó un incremento del 17% del riesgo de muerte que ascendía al 27% si existía un mal control de la presión arterial. Por lo tanto, el consejo actual es no superar los 12g de Hb, asegurar una repleción mantenida de los depósitos férricos asociando ferroterapia y controlar adecuadamente las cifras de presión arterial27. Análisis posteriores de estos ensayos han relacionado el aumento en la mortalidad en los pacientes tratados con EPO a la necesidad de altas dosis para conseguir la normalización de la Hb. Sabemos que algunos pacientes con IC presentan niveles altos de EPO endógena que se interpretan como resistencia de la médula ósea a la misma. Estos pacientes, con seguridad, precisarán altas dosis de EPO; por ello, la sugerencia de investigadores holandeses en utilizar los niveles basales de EPO para dirigir el tratamiento resulta atractiva28. Así, un nivel de EPO inferior al esperado según el grado de anemia permite aconsejar el uso de EPO exógena sin aumento aparente del riesgo cardiovascular. El beneficio en calidad de vida percibida por el paciente al conseguir aumentos de 1 o 2g de Hb, si su nivel es inferior a 9g, bien merece asumir el incremento del riesgo por los efectos negativos de la EPO; a saber: disminución de la producción de oxido nítrico, aumento de la presión arterial e incremento de la viscosidad sanguínea. Las dudas más importantes están en aquellos pacientes con anemias leves (Hb entre 10 y 12g en la mujer o entre 11 y 13g en el hombre), donde la decisión debe hacerse individualmente según el curso evolutivo de cada paciente.
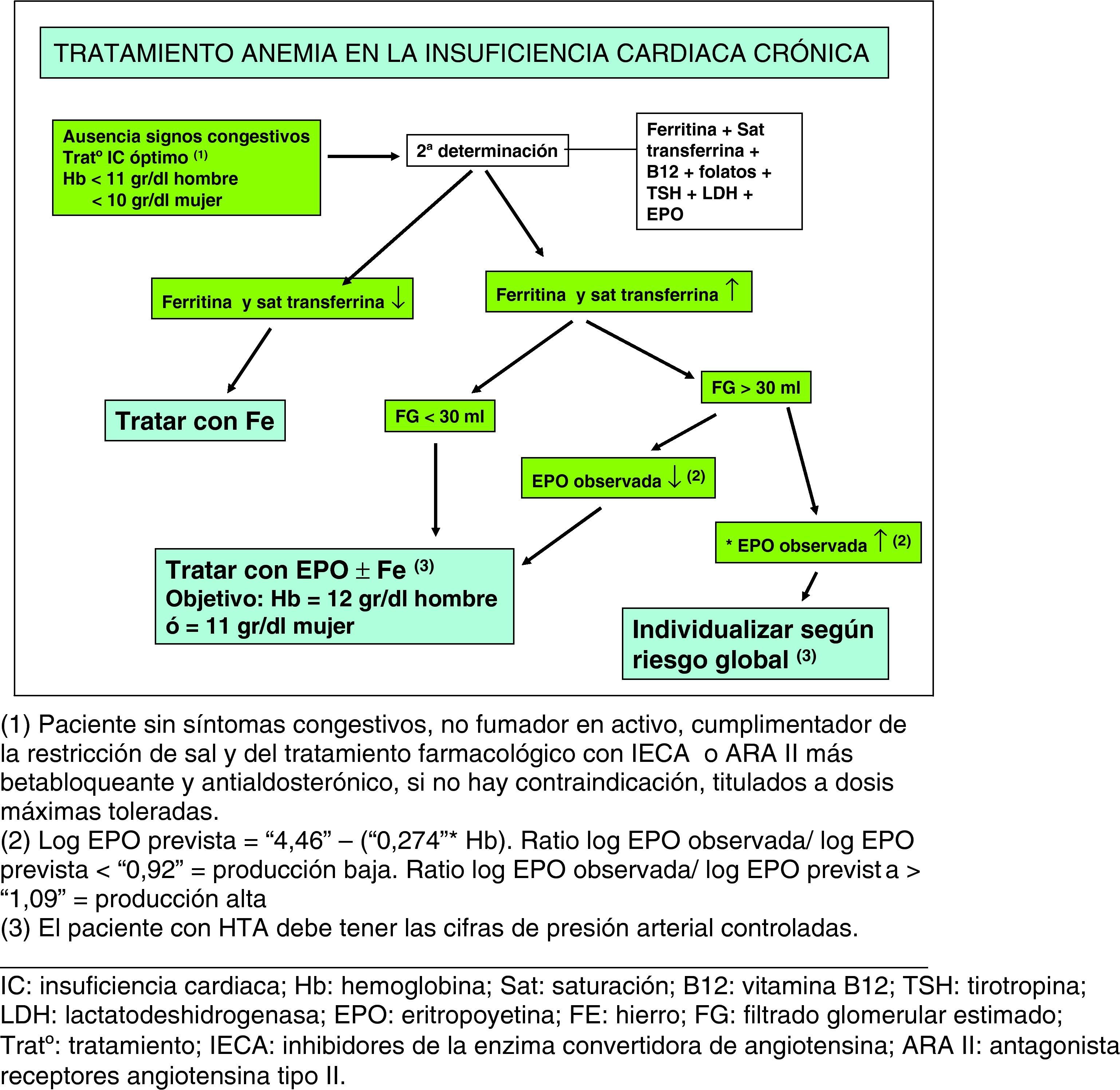
Resumen y conclusionesDesde el grupo de trabajo de la IC de la Sociedad Española de Medicina Interna (SEMI) proponemos un sencillo algoritmo de abordaje de la anemia en la insuficiencia cardiaca crónica (fig. 3). Tras excluir en estudio previo sangrado digestivo o hemopatía primaria, es necesario realizar un segundo hemograma de confirmación junto con determinación pretratamiento de la ferritina, saturación de la transferrina y EPO. Asimismo, se debe recordar la frecuencia de hipotiroidismo subclínico y de déficit de B12 o fólico en los pacientes con más de 65 años y, por lo tanto, recomendamos una nueva determinación de estos parámetros. La medición del nivel de EPO del paciente nos permite asegurar la necesidad de tratamiento sustitutivo para conseguir corregir la anemia, si se encuentra un valor por debajo de lo esperable en relación al nivel de Hb. Por el momento, este parece el mejor abordaje de este frecuente problema clínico en espera de los resultados del estudio RED-HF29, actualmente en marcha y cuyas primeras conclusiones se esperan para 2012.
En el caso propuesto se inició tratamiento con EPO y suplementos orales de Fe, manteniendo el resto de tratamiento sin modificación. A los dos meses, el hemograma mostraba un valor de Hb de 12,1g/dl con una creatinina plasmática de 2,02mg/dl, la paciente refería encontrarse bien, «como hace más de dos años que no me sentía»; de hecho, sale a dar un paseo por la calle dos veces al día, algo que no podía hacer los últimos 6 meses.