Como consecuencia inevitable de la inmigración latinoamericana, España y otros países europeos deben afrontar el abordaje de la infección/enfermedad chagásica de la que epidemiológicamente persisten más interrogantes que respuestas. El objetivo del estudio es describir la población diagnosticada de infección/enfermedad chagásica residente en la zona metropolitana norte de Barcelona (406.000 habitantes).
Pacientes y métodoEl estudio, prospectivo y multicéntrico en 3 hospitales y una unidad de salud internacional (2007-2011), incluyó a todos los pacientes con serología positiva a Trypanosoma cruzi solicitada por la razón que fuere.
ResultadosLos 139 casos estudiados representan unas incidencias anuales de: a) 0,68/10.000 habitantes, y b) 73,2/10.000 inmigrantes procedentes de zonas endémicas. Estaban enfermos (presentaron alteraciones en alguna prueba complementaria) 80 (57,6%): cardiológicas 62 (44,6%), gastroenterológicas 38 (27,3%) y 20 (14,4%) ambas. Según el Consenso Brasileño de cardiopatía chagásica, se encontraban en estadio 0=84 (60,4%); a=40 (28,7%); b1=4 (2,9%), b2=10 (7,2%) y c/d=1 (0,7%) pacientes. Se indicó tratamiento (benznidazol 5mg/kg/24h durante 60 días) en 116 (83,4%) pacientes, y 89 (76,7%) lo completaron. Presentaron efectos secundarios 56 (50,9%), lo que obligó a retirarlo en 21 ocasiones (19,1%).
ConclusionesEn la zona metropolitana norte de Barcelona han sido diagnosticados menos casos de infección/enfermedad chagásica de los esperables. La serie contiene un elevado número de pacientes enfermos y posiblemente haya un número elevado de inmigrantes procedentes de zonas endémicas en la fase crónica asintomática de la infección que ignoran su estado.
As an inevitable consequence of Latin American immigration to Europe, Spain and other European countries, it is necessary to confront the approach to cases of Chagas infection/disease for which, epidemiologically, there are more questions than answers. This study has aimed to describe all the Chagas-infected population in the north metropolitan area of Barcelona (406,000 inhabitants).
Patients and methodsA prospective and multicentric study was performed in 3 hospitals and 1 International Health Unit. It included all patients with Trypanosoma cruzi positive serology, regardless of the requesting reason.Results The 139 diagnosed cases represent an annual incidence of: a) 0.68/10,000 inhabitants and, b) 73.2/10,000 immigrants coming from endemic zones. Of the patients, 80 (57.6%) had alterations in some complementary tests: cardiologic 62 (44.6%), digestive 38 (27.3%) and 20 (14.4%) both. According to the Brazilian Consensus of Chagas cardiomyopathy, they were classified as: 0=84 (60.4%); a=40 (28.7%); b1=4 (2.9%), b2=10 (7.2%) and c/d=1 (0.7%). Treatment with benznidazole (5mg/kg/24h for 60 days) was prescribed in 116 (83.4%) patients, 89 (76.7%) of whom completed it. Secondary effects were recorded in 56 (50.9%), which made it necessary to withdraw it in 21 (19.1%).
ConclusionsFewer cases of Chagas infection/disease than expected have been diagnosed in the North Metropolitan area of Barcelona. The series contains a high number of patients and there may be an elevated number of immigrants from endemic zones who have the asymptomatic chronic stages of the infection and who were unaware of their condition.
La enfermedad de Chagas se limitaba al área de distribución de los vectores en el ecosistema neotropical (Centro y Sudamérica). Sin embargo, la inmigración ha conllevado su aparición en países desarrollados. España es, junto a Estados Unidos, el país no endémico donde se registran más casos. El objetivo del presente estudio es describir epidemiológica y clínicamente a la población diagnosticada de infección por T. cruzi en nuestro medio.
¿Qué aporta este artículo?El número de pacientes diagnosticados de infección por T. cruzi es inferior al esperable. La mayoría de ellos están asintomáticos, pero muestran alteraciones en las pruebas complementarias cardiológicas o esofágicas. Se debería fomentar el conocimiento de la infección/enfermedad de Chagas tanto entre la población de riesgo como entre los profesionales sanitarios.
Los Editores
La enfermedad de Chagas es una parasitosis crónica debida al protozoo flagelado Trypanosoma cruzi (T. cruzi). Su transmisión en el ciclo vital salvaje o peridoméstico requiere la participación de un vector, un chinche hematófago de la subfamilia Triatominae (Triatoma infestans, Rhodnius prolixus y otras especies) ausente en Europa. Aunque se han logrado avances en su control, la existencia de ciclos salvajes de la enfermedad la convierten en inerradicable1,2.
La primoinfección se manifiesta clínicamente durante la infancia como una enfermedad febril aguda y autolimitada. No obstante, sus formas no flageladas intracelulares (amastigotes) persisten indefinidamente en los tejidos, especialmente en las células nerviosas de los plexos digestivos y en el miocardio. Dependiendo de la virulencia de la cepa parasitaria y de los actores relacionados con la inmunidad del huésped, en aproximadamente un tercio de los infectados, el daño tisular es marcado y progresa inexorablemente hacia una cardiopatía, enfermedad digestiva o, más raramente, neuropatía3,4.
Históricamente limitada al área de distribución de los vectores en el ecosistema neotropical (Centro y Sudamérica), la inmigración ha conllevado su aparición en los países desarrollados. España, receptora de más de un millón de inmigrantes procedentes de países endémicos es, junto con Estados Unidos, el país no endémico donde se registran más casos. La presencia de personas infectadas y la existencia de vías de transmisión no-vectorial (transfusional, materno-fetal y transplantativa) han requerido la puesta en marcha de protocolos diagnósticos y terapéuticos, así como programas preventivos específicos5.
El objetivo del presente estudio es describir epidemiológica y clínicamente a la población diagnosticada de infección por T. cruzi en 4 centros de la zona metropolitana norte de la ciudad de Barcelona.
Pacientes y métodosSe trata de un estudio observacional multicéntrico y prospectivo de todos los casos diagnosticados de infección o enfermedad chagásica durante 5 años naturales (desde enero de 2007, momento en que se obtuvo el acceso a la serología de T. cruzi, hasta diciembre de 2011) en 3 hospitales (Germans Trias i Pujol, Municipal de Badalona y Esperit Sant) y una Unidad de Salud Internacional (ICS Metropolitana Nord) pertenecientes a la red de uso público de Catalunya y financiados por el sistema nacional de salud. Dichos centros comparten el mismo protocolo de diagnóstico, manejo y tratamiento de la infección chagásica y monitorizan conjuntamente sus respectivos casos en sesiones clínicas mensuales6.
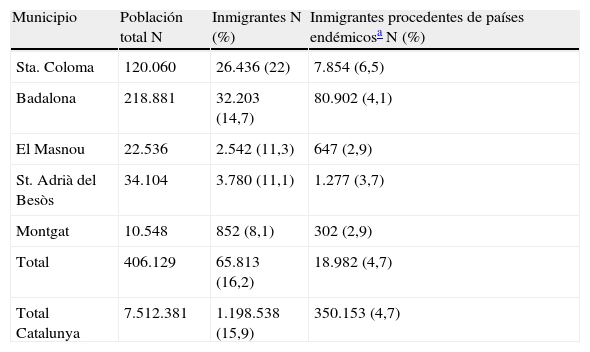
Su área de atención la componen los municipios de Santa Coloma de Gramanet, Badalona, El Masnou, Sant Adrià del Besòs y Montgat situados en la zona metropolitana norte de Barcelona, con un total de 406.129 habitantes. Mayoritariamente se trata de antiguas poblaciones obreras donde se ha asentado una inmigración que posee un poder adquisitivo menor al de la media española. Para determinar la incidencia de la infección/enfermedad de Chagas se usaron como denominadores el número de habitantes, inmigrantes totales e inmigrantes procedentes de países endémicos según datos obtenidos del único padrón realizado durante el período de estudio, en 2010 (que incluye también inmigrantes irregulares) de cada uno de los municipios (tabla 1)7. Se sumaron todos aquellos procedentes de México, Guatemala, Honduras, El Salvador, Belice, Nicaragua, Costa Rica, Panamá, Colombia, Venezuela, Guyana, Surinam, Brasil, Ecuador, Perú, Bolivia, Paraguay, Chile, Uruguay y Argentina. En el área de estudio, los médicos de Atención Primaria, especialistas hospitalarios y comadronas de los centros de atención prenatal disponen de las serologías de T. cruzi en su petitorio analítico. La única recomendación de cribado poblacional de la enfermedad durante el período de estudio se dirigía a las mujeres embarazadas8, por lo que la decisión de solicitar la serología a un paciente procedente de una zona endémica se basaba, fundamentalmente, en el criterio profesional o en la petición expresa del paciente.
Población total, inmigrante e inmigrante procedente de países endémicos en la zona metropolitana Norte de Barcelona
| Municipio | Población total N | Inmigrantes N (%) | Inmigrantes procedentes de países endémicosa N (%) |
| Sta. Coloma | 120.060 | 26.436 (22) | 7.854 (6,5) |
| Badalona | 218.881 | 32.203 (14,7) | 80.902 (4,1) |
| El Masnou | 22.536 | 2.542 (11,3) | 647 (2,9) |
| St. Adrià del Besòs | 34.104 | 3.780 (11,1) | 1.277 (3,7) |
| Montgat | 10.548 | 852 (8,1) | 302 (2,9) |
| Total | 406.129 | 65.813 (16,2) | 18.982 (4,7) |
| Total Catalunya | 7.512.381 | 1.198.538 (15,9) | 350.153 (4,7) |
Fuente: Datos del IDESCAT sobre el padrón de 20107.
De acuerdo con la Organización Mundial de la Salud (OMS)9, se considera a una persona como «infectada» cuando presenta 2 serologías positivas a T. cruzi, mediante 2 técnicas diferentes o mediante ELISA dirigidos a antígenos distintos. En el presente estudio se usó la combinación de ELISA nativo (n-EIA Ortho® Tcruzi Elisa Test System) y ELISA recombinante (r-EIA Bioelisa Chagas Biokit®). Se consideró como «enfermo» cuando además de las serologías el paciente presentaba alguna alteración en las pruebas complementarias cardiológicas o digestivas realizadas.
Se incluyeron en el estudio a los pacientes infectados o enfermos que: a) residieran en el área geográfica de estudio y, b) tuvieran registrados los datos correspondientes a la primera visita, que incluían datos socio-demográficos, exploración clínica y electrocardiograma (ECG).
Se valoraron las siguientes variables: edad, sexo, país de nacimiento, origen rural (sí/no), casa de adobe (sí/no), antecedentes familiares de infección/enfermedad chagásica (sí/no/no lo sabe), antecedentes maternos (sí/no/no lo sabe), nivel de diagnóstico (médico de Atención Primaria, especialista hospitalario, comadrona/ginecólogo), presencia de sintomatología cardíaca (síncopes, palpitaciones, disnea de esfuerzo y dolor torácico: sí/no), presencia de clínica digestiva (disfagia, pirosis-reflujo y constipación: sí/no), ECG, ecocardiografía transtorácica (ECC), registro ECG de 24h (ECG-Holter). El ECG incluía el modo de 12 derivaciones más un registro de 30 s en D2. La ecocardiografía se valoró en método bidimensional y en Doppler. Para la valoración funcional del esófago se empleó un manómetro de alta resolución, cuyos resultados proceden de la integración informática de sus 36 electrodos. No obstante, al igual que en el caso de esofagografía y enema opaco, solo se indicaba a los individuos que referían alguna clínica digestiva. A fin de descartar la presencia de otras enfermedades que con frecuencia pueden afectar funcionalmente al corazón o sistema digestivo, se solicitó a los pacientes un análisis bioquímico (que incluía la glucemia, función renal y hepática, calcemia, TSH y anticuerpos antinucleares), 3 muestras de parásitos en heces y la determinación de Helicobacter pylori mediante el test del aliento.
Se consideró que existía alteración cardiológica cuando se detectaban alteraciones en el ECG (definiendo la bradicardia sinusal como la frecuencia cardíaca <55lpm, la hipertrofia ventricular izquierda según los criterios de Sokolow-Lyon y las alteraciones de la repolarización como la duración del intervalo Q-T>0,4 s para frecuencias cardíacas >50lpm y/o su desnivelación difusa), en la ECC (definiendo la fracción de eyección disminuida como aquella <55%) o en el ECG-Holter. Se consideró que había alteración digestiva cuando se detectaban alteraciones en el esofagograma o en la manometría esofágica (valorando la proporción de ondas peristálticas normales, hipo/hipertensivas, simultáneas o no transmitidas, así como las presiones esofágica y esfinteriana inferior) o en el enema opaco. En base a los datos anteriormente indicados se estableció el estadiaje cardíaco según el Consenso Brasileño Modificado10 (tabla 2), diagnóstico final (infectado o enfermo).
Consenso Brasileño Modificado de miocardiopatía chagásica
| 0: ECG normal |
| a: ECG anormal. Ecocardiografía normal. No presencia de signos de IC |
| b1: ECG anormal. Ecocardiografía anormal con FE>45%. No presencia de signos de IC |
| b2: ECG anornal. Ecocardiografía anormal con FE<45%. No presencia de signos de IC |
| c: ECG anormal. Ecocardiografía anormal. Presencia de IC compensada |
| d: ECG anormal. Ecocardiografía anormal. Presencia de IC refractaria |
ECG: electrocardiograma; EF: fracción de eyección; IC: insuficiencia cardíaca.
Por otra parte, se registró el número de pacientes tratados de la enfermedad de Chagas, si finalizaban el tratamiento y la presencia de efectos secundarios. El tratamiento consistió en benznidazol a razón de 5mg/kg cada 24h con un máximo diario de 300mg. Se consideró un tratamiento como correctamente realizado si fue posible mantenerlo durante un período de 60 días consecutivos.
La frecuencia relativa de las variables y su asociación con características sociodemográficas se analizaron mediante el programa SPSS® 12.0 (SPSS Inc, Chicago, IL, EE.UU.). Se definieron como variables dependientes la alteración cardiológica, la alteración digestiva, la finalización del tratamiento y el diagnóstico final. Para evaluar la relación entre las variables dependientes y las características sociodemográficas de la población estudiada se aplicó un análisis bivariado. Para la comparación de variables cualitativas se usó la prueba Chi-cuadrado y para variables continuas la prueba de ANOVA de un factor. Los resultados se presentan en forma de odds ratio (OR) con intervalos de confianza del 95% (IC del 95%). El riesgo alfa aceptado para todas las pruebas estadísticas fue del 5%, bilateral.
ResultadosDurante el período de estudio se diagnosticaron 167 casos de infección por T. cruzi. De ellos, se excluyeron del estudio 28 (20 por residir fuera de zona, 7 por carecer de los datos de primera visita y un caso de transmisión materno-fetal). El total de pacientes estudiados fue de 139. La incidencia media anual de la infección/enfermedad de Chagas durante el período de estudio fue de: a) 0,66/10.000 habitantes y año, y b) 14,9/10.000 inmigrantes procedentes de zonas endémicas y año.
La serie estudiada se caracteriza por el predomino de pacientes en la cuarta década de la vida (edad media=37,79). Hay una mayoría de mujeres (61,2%), de pacientes bolivianos (94,2%) y de origen rural (92,8%). El resumen de los datos sociodemográficos se presenta en la tabla 3, las alteraciones cardiológicas en la tabla 4 y las gastroenterológicas en las tablas 4 y 5. Un total de 9 (6,5%) mujeres fueron diagnosticadas por cribado en el marco del programa de prevención de la transmisión materno-fetal de la enfermedad de Chagas.
Datos sociodemográficos de los pacientes con infección o enfermedad de Chagas
| Variable | N (%) |
| Edad; media (DE) | 37,79 (9,9) |
| Sexo | |
| Varón | 54 (38,8) |
| Mujer | 85 (61,2) |
| País de nacimiento | |
| Bolivia | 131 (94,2) |
| Otros países endémicosa | 8 (5,8) |
| Origen rural | 129 (92,8) |
| Casa de adobe | 127 (91,3) |
| Antecedentes familiares infección por T. cruzi | |
| Sí | 95 (68,3) |
| No | 35 (25,2) |
| No lo sabe | 9 (6,5) |
| Antecedentes maternos infección por T. cruzi | |
| Sí | 37 (266) |
| No | 84 (604) |
| No lo sabe | 18 (12,9) |
| Nivel de diagnóstico | |
| Médico de Atención Primaria | 104 (74,8) |
| Especialista hospitalario | 27 (19,4) |
| Comadrona/ginecólogo | 8 (5,8) |
| Inmunodeprimidos | |
| Positivos al virus de inmunodeficiencia humana | 4 (2,9) |
| Inmunosupresión inducida | 3 (2,2) |
| Diagnóstico final | |
| Infectados | 59 (42,4) |
| Enfermosb | 80 (57,6) |
Alteraciones cardiológicas en 139 pacientes infectados o enfermos de Chagas
| Tipo de prueba | N (%) |
| ECG (n=139) | |
| Normal | 84 (60,4) |
| Anormal | 55 (39,6) |
| Bloqueo sino-auricular | 2 (1,4) |
| Bradicardia sinusal | 12 (8,6) |
| Bloqueo de rama derecha (BRD) | 16 (11,5) |
| Hemibloqueo anterior (HBA) | 11 (7,9) |
| Bloqueo de rama izquierda | 0 |
| Hemibloqueo posterior | 2 (1,4) |
| BRD+HBA | 4 (2,9) |
| Fibrilación auricular | 2 (1,4) |
| Bloqueo aurículo-ventriculara | 6 (4,3) |
| Extrasístoles ventriculares | 9 (6,5) |
| Alteraciones de la repolarización: | 2 (1,4) |
| →Pacientes con 2 anormalidades | 9 (6,5) |
| →Pacientes con 3 anormalidades | 2 (1,4) |
| Ecocardiografía (n=88) | |
| Normal | 68 (77,3) |
| Anormal | 20 (22,7) |
| Alteraciones en la relajación VE | 7 (7,9) |
| Aneurisma ventricular (apical u otro) | 2 (2,3) |
| Fracción de eyección baja | 9 (10,2) |
| Otras anormalidadesb | 2 (2,3) |
| Holter (n=18) | |
| Normal | 12 (66,7) |
| Anormal | 6 (33,3) |
| Bradicardia severa | 4 (22,2) |
| Taquicardia supraventricular | 2 (11,1) |
| Alguna prueba cardiológica anormal | 62 (44,6) |
| Estadiaje según el Consenso Brasileño de cardiopatía chagásica | |
| 0 | 84 (60,4) |
| a | 40 (28,7) |
| b1 | 4 (2,9) |
| b2 | 10 (7,2) |
| c | 1 (0,7) |
| d | 0 |
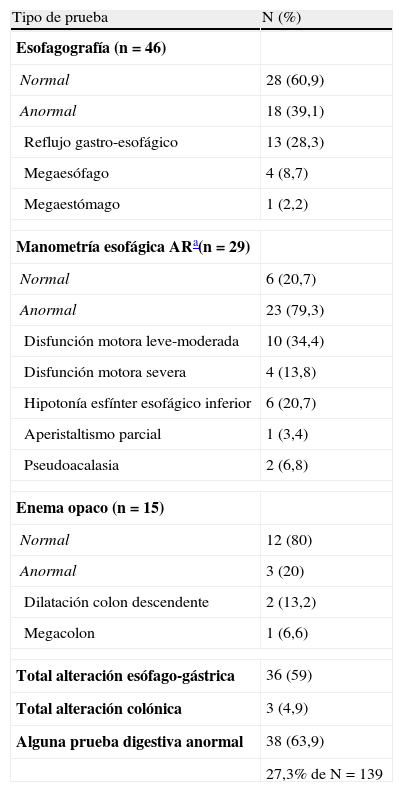
Alteraciones digestivas en pacientes infectados o enfermos de Chagas (61 pacientes con al menos una prueba digestiva realizada)
| Tipo de prueba | N (%) |
| Esofagografía (n=46) | |
| Normal | 28 (60,9) |
| Anormal | 18 (39,1) |
| Reflujo gastro-esofágico | 13 (28,3) |
| Megaesófago | 4 (8,7) |
| Megaestómago | 1 (2,2) |
| Manometría esofágica ARa(n=29) | |
| Normal | 6 (20,7) |
| Anormal | 23 (79,3) |
| Disfunción motora leve-moderada | 10 (34,4) |
| Disfunción motora severa | 4 (13,8) |
| Hipotonía esfínter esofágico inferior | 6 (20,7) |
| Aperistaltismo parcial | 1 (3,4) |
| Pseudoacalasia | 2 (6,8) |
| Enema opaco (n=15) | |
| Normal | 12 (80) |
| Anormal | 3 (20) |
| Dilatación colon descendente | 2 (13,2) |
| Megacolon | 1 (6,6) |
| Total alteración esófago-gástrica | 36 (59) |
| Total alteración colónica | 3 (4,9) |
| Alguna prueba digestiva anormal | 38 (63,9) |
| 27,3% de N=139 | |
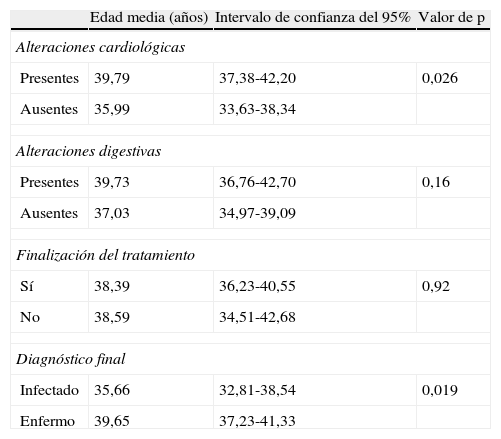
En el análisis bivariado la edad fue un factor relacionado con presentar alteraciones en las pruebas cardiológicas y con estar enfermo (tabla 6). Estar enfermo se relacionó significativamente con la presencia de síntomas digestivos (OR:3,1; IC del 95%: 1,5-6,5; p=0,002), pero no presentó relación con el sexo, el país de nacimiento, el origen rural, los antecedentes de vivienda de adobe, la presencia de antecedentes familiares o maternos de infección chagásica, el nivel asistencial de diagnóstico, la presencia de síntomas cardíacos y con finalizar el tratamiento.
Análisis bivariado (ANOVA de un factor). Presencia de alteraciones cardiológicas, digestivas, finalización del tratamiento y diagnóstico final en relación a la edad
| Edad media (años) | Intervalo de confianza del 95% | Valor de p | |
| Alteraciones cardiológicas | |||
| Presentes | 39,79 | 37,38-42,20 | 0,026 |
| Ausentes | 35,99 | 33,63-38,34 | |
| Alteraciones digestivas | |||
| Presentes | 39,73 | 36,76-42,70 | 0,16 |
| Ausentes | 37,03 | 34,97-39,09 | |
| Finalización del tratamiento | |||
| Sí | 38,39 | 36,23-40,55 | 0,92 |
| No | 38,59 | 34,51-42,68 | |
| Diagnóstico final | |||
| Infectado | 35,66 | 32,81-38,54 | 0,019 |
| Enfermo | 39,65 | 37,23-41,33 | |
Presentaron alteraciones en alguna prueba cardiológica 62 pacientes (44,6%) y gastroenterológica 38 pacientes (27,3%). Por lo tanto, estaban enfermos 80 (57,6%) pacientes ya que 20 (14,4%) mostraron alteraciones cardiológicas y digestivas simultáneamente. Durante el período de estudio, 4 (2,9%) pacientes pasaron de «infectados» a «enfermos» debido a la presencia de alteraciones sobre pruebas complementarias iniciales normales: 3 pasaron del estadio cardíaco «0» al «a» y uno presentó alteración esofágica a los 2 años de una manometría esofágica inicial normal. El tiempo medio de evolución fue de 31 meses.
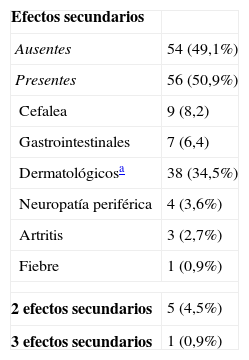
Iniciaron tratamiento con benznidazol 116 (82,1%) pacientes, de los que 6 (5,2%) se perdieron y no se dispone de información. Completaron correctamente la pauta de tratamiento 89 (76,7%). Entre los 110 pacientes monitorizados, 56 (50,9%) presentaron efectos secundarios atribuibles al fármaco y en 21 (19,1%) ocasiones debió suspenderse (tabla 7). A uno de los pacientes a los que hubo de suspenderse el tratamiento por la presencia de efectos secundarios se le indicó una pauta subsiguiente con nifurtimox (10mg/kg/24h durante 60 días), que pudo completar. Al considerar la finalización del tratamiento como variable dependiente tampoco se encontró relación con ninguna de las otras variables sociodemográficas aunque, por lo que se refiere al sexo, los varones lo finalizaron más que las mujeres (OR:2,4; IC del 95%: 0,94-6,29), al límite de la significación (p=0,06).
Efectos secundarios del tratamiento con benznidazol (datos de 110 pacientes)
| Efectos secundarios | |
| Ausentes | 54 (49,1%) |
| Presentes | 56 (50,9%) |
| Cefalea | 9 (8,2) |
| Gastrointestinales | 7 (6,4) |
| Dermatológicosa | 38 (34,5%) |
| Neuropatía periférica | 4 (3,6%) |
| Artritis | 3 (2,7%) |
| Fiebre | 1 (0,9%) |
| 2 efectos secundarios | 5 (4,5%) |
| 3 efectos secundarios | 1 (0,9%) |
El número de individuos diagnosticados de infección chagásica en la población procedente de países endémicos y residente en la zona metropolitana norte de Barcelona es menor de lo que a priori cabía esperar. Estudios europeos realizados entre la población inmigrante procedente de zonas endémicas sitúan la prevalencia de la infección por T. cruzi en un rango muy variable, pero notablemente superior: 15,9% en Madrid11, 12,8% en Ginebra12 (los 2 con una representación predominante de pacientes bolivianos) o, con especial relevancia por tratarse de un estudio de base comunitaria, del 3% en la zona urbana de Barcelona13. Aún postulando una prevalencia baja de la infección, del 5%, ello representaría un déficit de más de 900 diagnósticos (unos 180 casos nuevos al año durante un período de 5 años), algo muy lejos del número descrito. Si la población boliviana siguiera acumulando >90% de los casos, algo acorde con otros estudios europeos, entonces deberían existir unos 850 individuos infectados procedentes de Bolivia. Incluso aceptando que algunos pacientes pueden haberse dirigido a reconocidas unidades de medicina tropical de la ciudad de Barcelona, es evidente que existe un gran número de personas infectadas sin diagnosticar. Si ello se debe a factores culturales como el miedo a la estigmatización de la enfermedad, o a factores organizativos como a los horarios laborales poco coincidentes con los de atención sanitaria, sería materia de debate. No obstante, la equidad del sistema público en España y la accesibilidad a la serología tripanosómica por parte de los médicos de Atención Primaria hacen poco plausible la existencia de barreras al diagnóstico. Si otros estudios confirmaran esta hipótesis, debería considerarse la posibilidad de un abordaje comunitario de la infección, y quizá su inclusión en el «Programa de Actividades Preventivas del Adulto en Atención Primaria» como algunos propugnan14.
En contraste con dicha baja incidencia, las pruebas complementarias realizadas mostraron una muy alta proporción de afectación orgánica, es decir, de «enfermos». Por lo que se refiere a las pruebas cardiológicas se registraron alteraciones en el 44,6% de los pacientes, confirmando las tasas obtenidas en un estudio anterior (49%)15. La proporción de individuos con alguna alteración digestiva fue asimismo alta (27,3%)16, pero explicable debido a la selección de los pacientes estudiados (solo se indicaban en caso de la presencia de sintomatología digestiva), al uso de técnicas muy sensibles y al origen boliviano de la mayoría de los pacientes; población principalmente infectada por el linaje filogenético IIc de T. cruzi, muy afín por el sistema digestivo17.
No obstante, y en su conjunto, esta alta proporción de enfermos podría deberse a que la casuística no deriva de un programa de cribado poblacional, ni de un estudio que pretende determinar la prevalencia de la enfermedad, sino de pacientes que en su mayoría acudieron a su médico de Atención Primaria por propia iniciativa18. Presumiblemente las personas enfermas consultarían más precozmente a los servicios sanitarios con motivo de la presencia de síntomas subjetivamente atribuidos a la enfermedad de Chagas.
El análisis de los factores de riesgo relacionados con presentar enfermedad de Chagas cardiológica o digestiva es poco determinante. El único factor de riesgo que incuestionablemente incrementa las posibilidades de estar enfermo es la edad al momento del diagnóstico, algo sobre lo que existe suficiente evidencia. La ausencia de relación con factores como el sexo (los varones enferman más y evolucionan peor)19, el origen rural (el Chagas es un endemia propia de zonas rurales) o la presencia de antecedentes familiares20 o maternos21 puede reflejar el obvio sesgo cometido al estudiar una enfermedad endémica fuera de su entorno ecológico y social.
Por lo que se refiere a las alteraciones en el ECG, la presencia de bloqueo de rama derecha, hemibloqueo anterior o ambos estaban presentes en orden decreciente en 31 de los 55 ECG anormales. Estos bloqueos de rama, así como la disfunción diastólica en la ECC se describen típicamente en los estadios iniciales de la miocardiopatía chagásica, y pueden constituir una de las indicaciones principales de tratamiento22,23. La clasificación derivada del «Consenso Brasileño Modificado de cardiopatía chagásica» puede ser de utilidad en tanto que permite comparar series de enfermos y monitorizar su evolución. No obstante, es de destacar que fueron clasificados como en estadio cardiológico «0» un total de 6 pacientes «enfermos» con ECG normal, pero ECC alterada. Esto se explica porque originalmente para los autores del «Consenso Brasileño», existían dudas de que ante un ECG normal las eventuales alteraciones ecocardiográficas pudieran atribuirse a la enfermedad de Chagas. El posterior reconocimiento de la disfunción diastólica y la hiperproducción secundaria de factor natriurético como uno de los indicadores precoces de daño miocárdico conllevaron su revisión24. Por lo tanto, la utilidad del «Consenso Brasileño» en entornos como el nuestro donde se recomienda el ECG y la ECC como pruebas indicadas en el estudio inicial de pacientes con serología positiva tiene sus limitaciones. Algunos autores propugnan su sustitución por los criterios del reciente «Consenso Internacional de Buenos Aires» (2010; OPS/WHO), más simple y categórico25.
La proporción de pacientes que finalizan el tratamiento, que presentan efectos secundarios, y que deben interrumpirlo debido a que estos son similares a los obtenidos en otros estudios y ofrecen una idea sobre la escasa tolerabilidad del benznidazol, fármaco que por otra parte, podría alcanzar una tasa de curación del 15-20% en el mejor de los casos26,27. Cabe dentro de lo posible, que la medicación presente un peor perfil de efectos secundarios en las mujeres y en los pacientes ancianos28. En nuestra serie no hay pacientes de más de 60 años, con lo que los resultados podrían reflejar dicha tendencia negativa entre las mujeres.
A día de hoy podría aún hablarse del Chagas como una enfermedad «huérfana» de tratamiento, y prueba de ello es la constatación de la evolución de infectado a enfermo en 4 casos, lo que representaría una tasa próxima al 1-2% anual considerado el propio de la evolución natural de la enfermedad. A la espera de los resultados del estudio BENEFIT (cuyo objetivo es dilucidar con mayor exactitud el papel del benznidazol en la terapéutica antitripanosomal)29 hay esperanzas fundadas de poder disponer en un futuro próximo de mejores tratamientos basados en diversas familias de nuevos fármacos, especialmente los antifúngicos inhibidores de la síntesis de ergosterol30,31.
Entre las limitaciones de nuestro estudio conviene destacar que los resultados en cuanto a la presencia de alteraciones esofágicas se han basado en el empleo de la manometría de alta resolución. Las ventajas del uso de una prueba complementaria de tan alta sensibilidad en la enfermedad de Chagas aún están por determinar, y podría haber sesgado los resultados al alza, aunque existen estudios coincidentes con una frecuencia de alteraciones esofágicas similares32 e incluso superiores33. El diseño de un estudio comparando los resultados obtenidos con los de una cohorte de pacientes inmigrantes latinoamericanos no-infectados con T. cruzi es una de las directrices a las que apunta el presente estudio. Hasta entonces los resultados deben ser tomados con cautela.
Es razonable pensar que el estudio sea representativo de los pacientes «enfermos» de Chagas en la zona metropolitana norte de Barcelona, pero es dudoso que represente a la población «infectada» en su conjunto teniendo en cuenta la diferencia entre el número de casos descrito y el estimado.
En conclusión, en la zona metropolitana norte de Barcelona el número de pacientes diagnosticados de infección por T. cruzi es muy inferior al número total esperable de pacientes infectados. Posiblemente exista un número elevado de inmigrantes procedentes de zonas endémicas en la fase crónica asintomática de la infección que desconoce su estado. Se debería fomentar el conocimiento de la infección/enfermedad de Chagas tanto entre la población de riesgo como entre los profesionales sanitarios, así como valorar la inclusión de cribado de la población inmigrante procedente de zonas endémicas en las recomendaciones del «Programa de Actividades Preventivas del Paciente Adulto».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- –
Xavier de Balanzó: Servicio de Cuidados Intensivos, Hospital de Mataró, Mataró, España.
- –
Gemma Falguera: Coordinadora PASSIR Vallès, Gerència Territorial Metropolitana Nord (ICS), Sabadell, España.
- –
Gema Fernández-Rivas: Servicio de Microbiología, Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona, España.
- –
Cèlia Guardià: Laboratorio del ICS - Barcelonés Nord i Vallès Oriental, Badalona, Barcelona, España.
- –
Lourdes Mateu: Unidad de Enfermedades Infecciosas, Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona, España.
- –
M. Lluïsa Pedro-Botet: Unidad de Enfermedades Infecciosas, Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona, España.