Protocolos para el manejo de la Enfermedad Tromboembólica Venosa
Más datosA pesar de los beneficios potenciales de la atención ambulatoria, la mayoría de los pacientes que sufren de embolia pulmonar son hospitalizados por temor a posibles eventos adversos. Sin embargo, existe ya una abundante evidencia científica, procedente de estudios que incluyen más de 4.000 pacientes ambulatorios, que ha llevado a las Guías de Práctica Clínica (GPC) actuales a avalar un tratamiento ambulatorio o de alta temprana cuando pueda confirmarse que el riesgo de muerte o de complicaciones sea bajo, no haya comorbilidades o procesos agravantes que aconsejen la hospitalización y se observen un seguimiento y un tratamiento apropiados. Tal actuación minimiza las complicaciones que puedan surgir en el hospital y suponen un considerable ahorro en los costes. En la selección de estos pacientes adquieren importancia capital las herramientas pronósticas, como el Pulmonary Embolism Severity Index (PESI), su versión simplificada (sPESI) o los Criterios de Hestia. Aplicando tales herramientas se observan mortalidades bajas a corto plazo (30-90días): en general <3%, además de baja incidencia de otras complicaciones (recidivas, hemorragias importantes: <2%). Así pues, y con la evidencia disponible, el tratamiento ambulatorio puede considerarse actualmente como la más pertinente práctica para la mayoría de pacientes con embolia pulmonar hemodinámicamente estables.
Despite the potential benefits of outpatient care, most patients with pulmonary embolisms are treated in hospitals for fear of possible adverse events. However, there is a wealth of scientific evidence from studies covering more than 4000 outpatients, which has led the current clinical practice guidelines to recommend early discharge or outpatient treatment when a low risk of death or complications has been confirmed, when there are no comorbidities or aggravating processes present to warrant hospitalisation and when appropriate monitoring and treatment are observed. This approach minimises the complications that can arise in hospitals and represents considerable cost savings. When selecting these patients, the use of prognostic tools such as the Pulmonary Embolism Severity Index (PESI), its simplified version (sPESI) and the Hestia Criteria are of paramount importance. Using these tools, the short-term outcomes (30-90days) show low mortality (in general <3%) and a low incidence of other complications (rate of recurrence and major bleeding <2%). Based on the available evidence, outpatient treatment can be considered the most appropriate strategy at this time for most hemodynamically stable patients with pulmonary embolisms.
La enfermedad tromboembólica venosa (ETV) es un proceso potencialmente mortal, ya que el trombo inicialmente formado en el sistema venoso profundo (trombosis venosa profunda [TVP]) puede fragmentarse y producir embolia pulmonar (EP). La EP es la 3.ª causa de mortalidad cardiovascular (tras la cardiopatía isquémica y el ictus), con una mortalidad hospitalaria cercana al 10%1,2. Pero probablemente existe una significativa infravaloración de la mortalidad, pues se ha estimado que más del 30% de los pacientes pueden morir antes de llegar al hospital3. Cerca del 90% de las muertes ocurren en pacientes no tratados porque no fueron diagnosticados, mientras que su tratamiento precoz permite reducir la mortalidad desde el 30 al 8-5%4. Así mismo, la mortalidad se relaciona con su forma de presentación, pues si aparece como parada cardiorrespiratoria su mortalidad se aproxima al 70%, si lo hace como shock puede ser del 30%, mientras que en pacientes normotensos adecuadamente tratados puede disminuir al 2%5. A todo ello debe añadirse la disminución de la calidad de vida de los pacientes con ETV debido a las complicaciones. Entre ellas se encuentra el síndrome posflebítico/estasis venosa (incidencia acumulada: 30% a los 20años); hipertensión pulmonar (4% a los 2años tras la EP)6; recidivas al suspender la anticoagulación (10% [1año], 25% [5años], 36% [10años]; relación caso-mortalidad: 4%)7; hemorragias graves y potencialmente mortales; limitación de la capacidad funcional respiratoria (cerca del 50% de pacientes con EP refieren algún tipo de limitación al año del evento) o global (más del 30% de pacientes no se reincorporan a su trabajo un año tras el episodio)6,8.
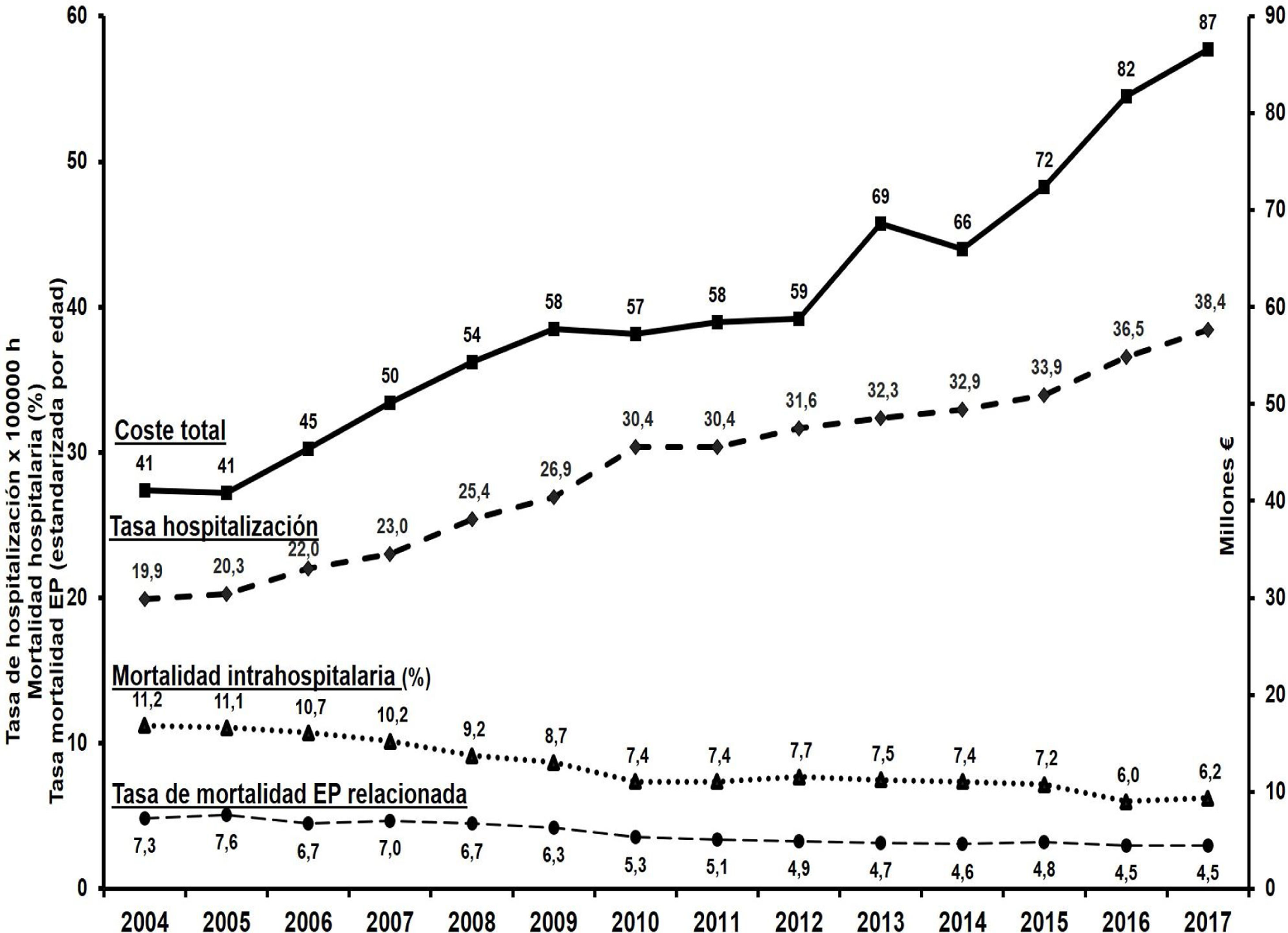
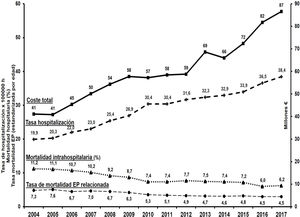
Se estima una incidencia de EP en población general de 39-115/100.000 personas/año, y de TVP de 53-162/100.000 personas/año. Existe acusada dependencia de la edad, siendo 8veces mayor en personas en la década de los ochenta que en los que están en la década de los cincuenta2,9,10. En el mundo se calculan cerca de 10millones de casos anuales de ETV. En Estados Unidos (2014) se estiman cerca de 676.000 TVP, 340.000 EP y 1.016.000 eventos totales por ETV y unas 60.000-100.000 muertes anuales (para una población de 319 millones)2,10,11. Los datos de mortalidad más actuales en Europa (datos de la OMS) cifran en 38.929 el promedio de muertes anuales relacionadas con EP (para una población de 651 millones [2015]). Al mismo tiempo se observa una disminución progresiva de la mortalidad europea por EP (del 12,8 [2000] al 6,5% [2015]; descenso de la tasa de mortalidad anual del 5,0%)12. Esas mismas cifras referidas a España proporcionan 2.232 muertes anuales (2015)12, con ligeras discrepancias con el INE, que las cifra en 2.03213 (con disminución de la mortalidad anual del 4,3% en el periodo 2000-2015 [de 8,7 a 4,8%]). En el periodo 2004-2017 la mortalidad intrahospitalaria por EP en el Sistema Nacional de Salud (SNS) descendió del 11,6% al 6,2%14. Tal mortalidad en descenso también se confirma en el Registro Informático de pacientes con Enfermedad Tromboembólica (RIETE) (la mortalidad a 30días en EP pasó del 6,6% [2001-2005] al 4,9% [2010-2013])15. Los últimos datos de dicho Registro (1 de marzo de 2020; 44.482 pacientes con EP) muestran una mortalidad (no ajustada) del 5,2%. Esta admite importantes matizaciones según la edad, pues es 3veces mayor en pacientes >81años (9,2%) respecto a los de 36-60años (3,1%). Para la TVP (36.540 pacientes), la mortalidad a 30días es del 2,6%16.
De otra parte, las hospitalizaciones en España, si bien cada vez más cortas (la estancia media en EP pasó de 11,6 [2004] a 8,7días [2017])14,17, siguen aumentando progresivamente (fig. 1)13,14 y ocurren en pacientes más ancianos (35% >80años en 2017)14 y con importantes comorbilidades: cáncer (20%), EPOC (16%), insuficiencia cardiaca (14%), diabetes mellitus (15%), etc.1. Debe notarse que los pacientes que desarrollan una EP en el hospital presentan mayor mortalidad que aquellos con ingreso primario por EP (36% vs. 10,5%)1. Además, los hospitalizados por ETV presentan mayor mortalidad que los ambulatorios17,18. Otros estudios encuentran que el 0,8% de las hospitalizaciones en el SNS sufren ETV sintomática (que corresponde a una tasa estimada de casos anuales de 154/100.000 habitantes (≈68.000 casos)19.
Evolución de las hospitalizaciones, los costes y la mortalidad por EP en España.
Elaboración propia a partir de las referencias13-15,17.
Si tales cifras son preocupantes, lo son mucho más las tendencias previstas en los próximos años. Se estima en un 8,1% la posibilidad a los 45años de desarrollar ETV durante el resto de la vida11, posibilidad que aumenta al 10,9% en obesos o al 17,1% en presencia de factorV Leiden11. Estudios de proyección de mercados en 7 países desarrollados (Estados Unidos, Francia, Alemania, Italia, España, Reino Unido, Japón) estiman que los casos incidentes de ETV aumentarán de 896.377 (2016) a 1.071.438 (2026) (tasa anual de crecimiento: +2,0%). Con respecto a la EP, se estima que pasará de 276.732 casos incidentes a 327.416 (tasa anual: +1,8%). En este último apartado España será el país que experimente mayor crecimiento (tasa anual estimada: +3,5%): de 20.998 casos (2016) a 38.383 (2026). Además, el número europeo de pacientes médicos en riesgo de padecer ETV aumentará de 23,0 a 26,3 millones20.
La dimensión de estas cifras ocasiona que dichos procesos se consideren no solo ya como un preocupante problema sanitario, sino también económico. Los costes anuales europeos en relación con la ETV se estiman en 8.500 millones de euros2. En España se estiman los gastos anuales hospitalarios de la EP en unos 88 millones de euros (2017) (fig. 1), de los cuales el 85% corresponden a gastos de estancia hospitalaria14,16. Dadas tales magnitudes económicas, es comprensible el interés por los estudios que demuestren que una considerable proporción de pacientes con ETV pueden ser tratados ambulatoriamente de forma segura, eficaz y con notable ahorro de gastos.
Tratamiento domiciliario de la ETVEste trabajo se centrará fundamentalmente en el tratamiento ambulatorio de la EP (TtoAmb), pues la TVP, salvo casos excepcionales, debería tratarse rutinariamente de forma domiciliaria. Se ha calculado que cerca del 95% de pacientes que llegan al hospital con EP muestran estabilidad hemodinámica5,6. Las actuales Guías de Práctica Clínica (GPC)2,21-23 sugieren que entre el 30 y el 55% de pacientes con EP de bajo riesgo serían candidatos al TtoAmb o alta temprana. Sin embargo, se observa una importante dicotomía entre los ensayos clínicos y GPC y los datos del mundo real, que muestran que el 80-98% de pacientes con EP son tratados en el hospital6. Esto es debido a la variabilidad de los modelos asistenciales; por ejemplo, las cifras de TtoAmb en EP pueden ser tan bajas como un 2% en Italia, un 4% en Francia, un 14% en Estados Unidos, pero llegan a >50% en Canadá24. A ello se unen las peculiaridades geográficas, las consideraciones medicolegales y las actitudes de los médicos y las preferencias de los pacientes. Por ello, a continuación examinaremos las evidencias que apoyan el TtoAmb de la EP. Dicho tratamiento precisa un enfoque multidisciplinar, y para que sea eficaz y seguro conviene considerar varios componentes esenciales del mismo: selección adecuada de los pacientes, su educación, seguimiento cuidadoso y acceso a la asistencia sanitaria4,6,24,25.
Selección de los pacientesEs el campo más controvertido, puesto que los criterios de selección han sido variables entre los estudios. Deben identificarse los pacientes con mayor riesgo para desarrollar complicaciones propias de su enfermedad (progresión o recidiva) que requerirán ingreso y aquellos otros en que pueda considerarse un TtoAmb.
Evidencia científicaHay ya una notable evidencia científica que muestra que, en pacientes seleccionados, la EP puede tratarse de forma segura con TtoAmb o tras un alta precoz. Aun sin ser exhaustivos podemos mencionar:
Al menos 7 ensayos clínicos aleatorizados (revisados en2,6,24,25) han comparado los resultados de TtoAmb respecto al convencional entre pacientes con EP de bajo riesgo, con resultados similares y bajas cifras de mortalidad, recidivas y sangrado a los 3meses.
Varios metaanálisis26,27 y revisiones sistemáticas6,24 (con inclusión de cerca de 4.000 pacientes ambulatorios o >500 con alta temprana) y 2 revisiones Cochrane en 2018/201928 han corroborado estos resultados con muy bajas mortalidades (<3%) y bajas tasas de recidiva y sangrados.
Las más recientes GPC2,21-23, atendiendo a todas estas evidencias, recomiendan, pues, la consideración del TtoAmb o alta precoz (de 48h a <5 días) en la EP de bajo riesgo.
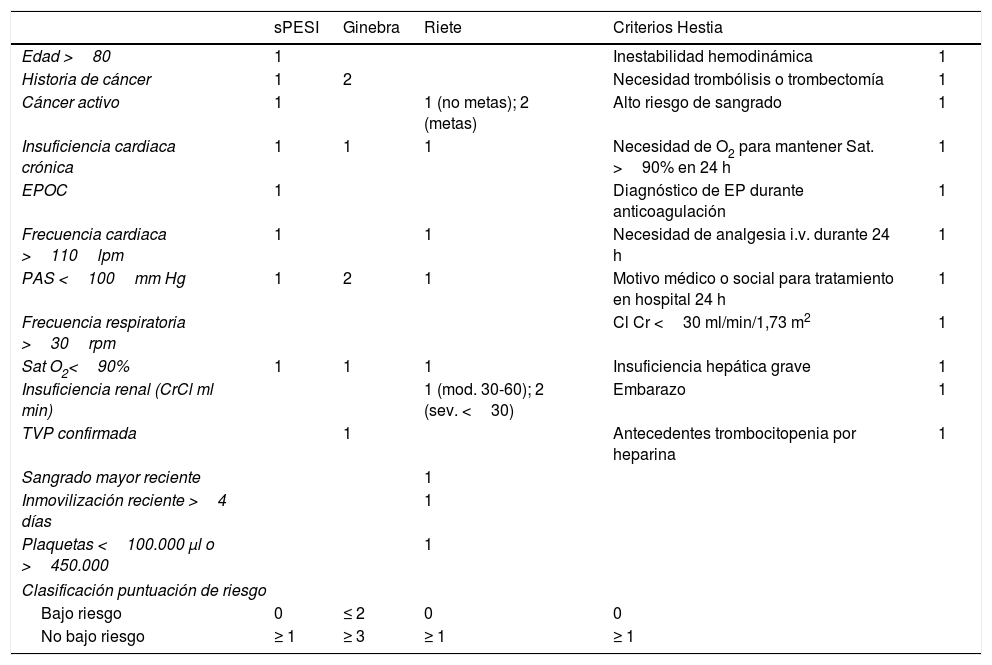
Estratificación de los pacientesEn la mayoría de estudios se insiste en una estratificación adecuada para identificar los pacientes con EP de bajo riesgo. A tal fin se han diseñado una serie de herramientas pronósticas, incluyendo algunas escalas de riesgo inmediato de complicaciones a 30días para la EP aguda (p.ej., FAST y Bova Score). La primera tiene el inconveniente de utilizar la proteína ligada a ácido graso de tipo cardiaco (HFABP), no fácilmente disponible. El Bova Score, que ya ha sido validado29, puntúa los parámetros PAS 90-100mmHg (+2), elevación de troponina (+2), disfunción ventricular por ecocardiograma o TAC (+2), frecuencia cardiaca >110lpm (+1) y estratifica en 3 estadios la mortalidad: I (0-2 puntos): 4,2%; II (3-4 puntos): 10,8%; III (>4 puntos): 29,2%. También la escala de estratificación de riesgo para EP de la GPC de la European Society of Cardiology de 2014 (ESC2014), actualizada en la ESC20192, ha sido validada prospectivamente30. Sin embargo, las más experimentadas y utilizadas son otras escalas, como la de Ginebra original y simplificada, el Pulmonary Embolism Severity Index (PESI), el PESI simplificado (sPESI), la escala de Ottawa, los Criterios de Hestia o la escala RIETE, que han demostrado su utilidad en estudios extensos2,5,6,29 (tabla 1). La escala PESI establece una estratificación mediante la puntuación de variables pronósticas de fácil obtención en los servicios de urgencias. Su simplificación (sPESI) parece sustituir ventajosamente a la más compleja PESI, siendo ambas ampliamente validadas2,6,29-32. Por ejemplo, un metaanálisis diseñado para la validación de estas escalas de riesgo de mortalidad a 30días encontró en puntuaciones PESI de bajo riesgo (<65 puntos) una mortalidad del 2,3% y para sPESI (0 puntos) de 1,5%. Para los pacientes de no bajo riesgo la mortalidad fue del 11,4% (PESI) y del 10,7% (sPESI)2,29,31. Por tanto, los pacientes con puntuaciones inferiores serían los ideales para TtoAmb, y para puntuaciones superiores debería considerarse tratamiento hospitalario.
Escalas de estratificación pronóstica en el embolismo pulmonar
| sPESI | Ginebra | Riete | Criterios Hestia | ||
|---|---|---|---|---|---|
| Edad >80 | 1 | Inestabilidad hemodinámica | 1 | ||
| Historia de cáncer | 1 | 2 | Necesidad trombólisis o trombectomía | 1 | |
| Cáncer activo | 1 | 1 (no metas); 2 (metas) | Alto riesgo de sangrado | 1 | |
| Insuficiencia cardiaca crónica | 1 | 1 | 1 | Necesidad de O2 para mantener Sat. >90% en 24 h | 1 |
| EPOC | 1 | Diagnóstico de EP durante anticoagulación | 1 | ||
| Frecuencia cardiaca >110lpm | 1 | 1 | Necesidad de analgesia i.v. durante 24 h | 1 | |
| PAS <100mm Hg | 1 | 2 | 1 | Motivo médico o social para tratamiento en hospital 24 h | 1 |
| Frecuencia respiratoria >30rpm | Cl Cr <30 ml/min/1,73 m2 | 1 | |||
| Sat O2<90% | 1 | 1 | 1 | Insuficiencia hepática grave | 1 |
| Insuficiencia renal (CrCl ml min) | 1 (mod. 30-60); 2 (sev. <30) | Embarazo | 1 | ||
| TVP confirmada | 1 | Antecedentes trombocitopenia por heparina | 1 | ||
| Sangrado mayor reciente | 1 | ||||
| Inmovilización reciente >4 días | 1 | ||||
| Plaquetas <100.000 μl o >450.000 | 1 | ||||
| Clasificación puntuación de riesgo | |||||
| Bajo riesgo | 0 | ≤ 2 | 0 | 0 | |
| No bajo riesgo | ≥ 1 | ≥ 3 | ≥ 1 | ≥ 1 | |
Así pues, las GPC del American College of Chest Physicians (ACCP) de 201621 y la ESC-20192 han recomendado la escalas PESI/sPESI. La GPC de la British Thoracic Society (BTS) de 201822 propone además los criterios de Hestia —que abordan una serie de cuestiones cuya respuesta positiva contraindicaría el TtoAmb—, que también se han validado prospectivamente29,33. La Escala RIETE5, aunque precisa su validación externa, incorpora un ítem referente a cáncer (como también las escalas PESI/sPESI, EPIPHANY y POMPE-C). Algunos estudios muestran que PESI/sPESI y los Criterios de Hestia tienen buena sensibilidad, aunque baja especificidad, en la estratificación pronóstica de pacientes con cáncer34.
Aunque en las GPC se señalan como útiles otras pruebas (ecocardiografía o TAC en la evaluación de sobrecarga de ventrículo derecho [VD], adición de troponina o fragmento aminoterminal del péptido natriuréticoB [NTproBNP] a las escalas)2,21,22, en general no se recomienda su realización rutinaria en la EP de bajo riesgo identificada por las escalas pronósticas, pues se carece de estudios prospectivos validados de su utilidad en índices pronósticos combinados2,5,6. Entre los estudios realizados, el Hestia evaluó por TAC la disfunción del VD en EP y la encontró en el 39% de 275 pacientes ambulatorios (serían, pues, pacientes de riesgo intermedio). A los 30días había muerto un paciente (0,6%) en el grupo sin disfunción VD y otro (1,1%) en el grupo con disfunción VD, ambos por causas no relacionadas con la EP. Por contraste, en pacientes hospitalizados (221) la disfunción de VD se encontró en el 59%, la mortalidad a 30días fue del 3,4% (sin disfunción VD) y del 3,8% (con disfunción VD)35. El estudio HOME-PE (https://www.clinicaltrials.gov, NCT02811237), con cerca de 2.000 participantes y pendiente de comunicación de resultados, evalúa la utilidad de los Criterios de Hestia frente a sPESI en el TtoAmb de la EP. Por su parte, el estudio VESTA no encontró que la adición de los niveles de NTproBNP a los Criterios de Hestia supusiera beneficio adicional en EP con bajo riesgo para TtoAmb36.
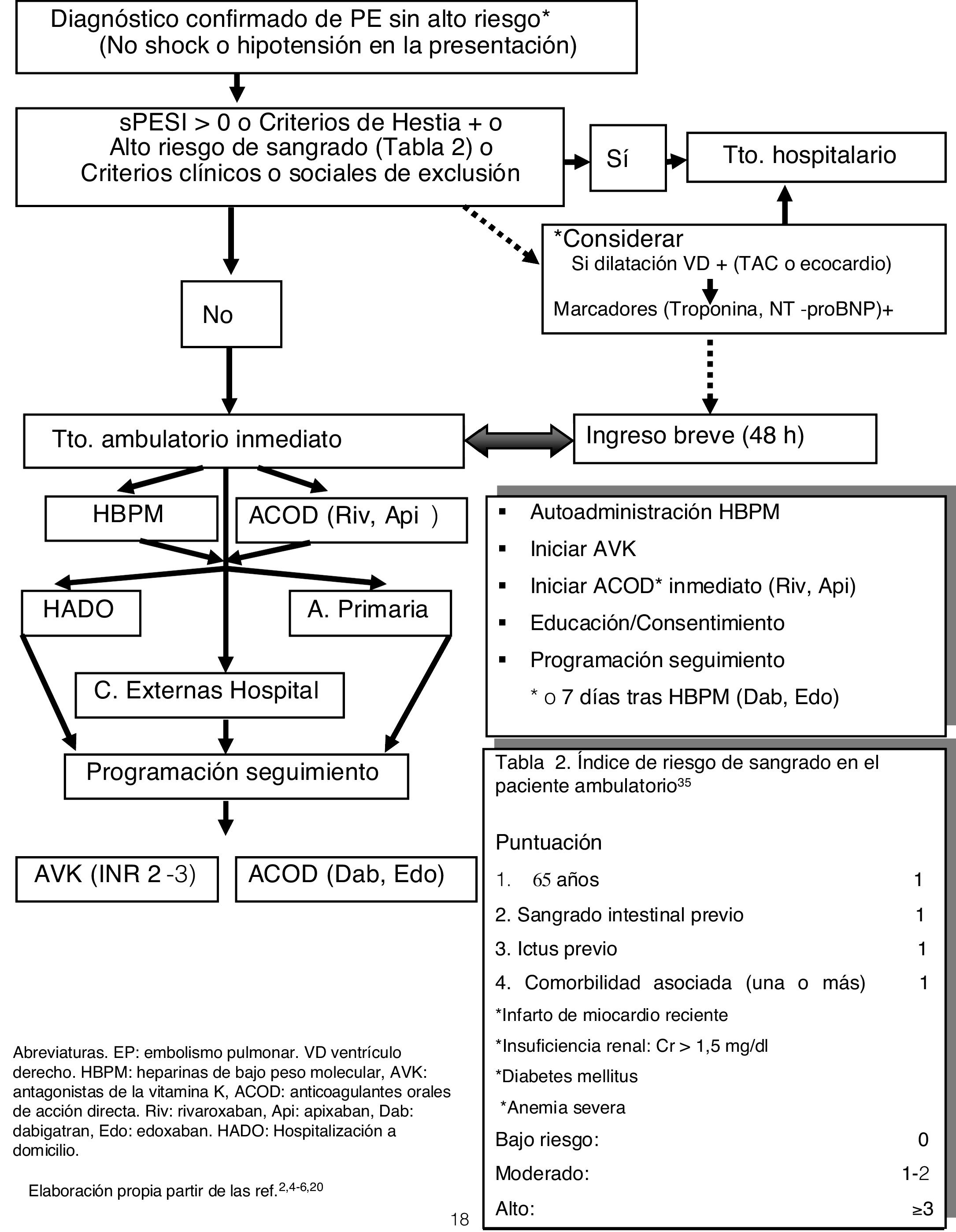
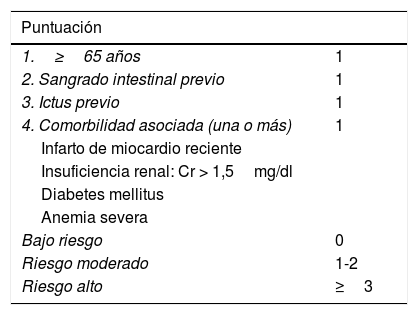
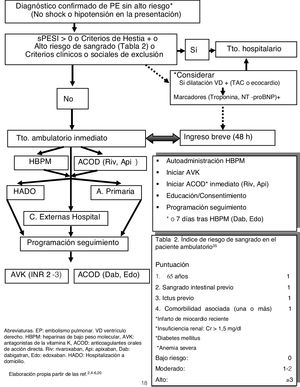
En la figura 2 se recoge un esquema basado en los estudios actuales y GPC y adaptado a nuestro entorno. En nuestro centro los pacientes con TVP y EP elegibles para TtoAmb son seguidos por la Unidad de Hospitalización Domiciliaria (HADO) o remitidos a las consultas externas. Respecto al sangrado, puede utilizarse de forma aproximativa el índice de riesgo de sangrado en el paciente ambulatorio, validado por Wells37 (tabla 2). En pacientes con dudas sobre el tratamiento una opción, por lo demás rutinariamente realizada en la mayoría de estudios sobre TtoAmb, es la hospitalización breve durante <48h (o 5días según las Guías ACCP de EP)21 para comprobar la factibilidad del tratamiento y la existencia de complicaciones.
Esquema de actuación en el tratamiento domiciliario del EP.
ACOD: anticoagulantes orales de acción directa; Api: apixabán; AVK: antagonistas de la vitamina K; Dab: dabigatrán; Edo: edoxabán; EP: embolismo pulmonar; HADO: hospitalización a domicilio; HBPM: heparina de bajo peso molecular; Riv: rivaroxabán; VD: ventrículo derecho.
Elaboración propia partir de las referencias 2,4-6,22.
Índice de riesgo de sangrado en el paciente ambulatorio37
| Puntuación | |
|---|---|
| 1.≥65 años | 1 |
| 2. Sangrado intestinal previo | 1 |
| 3. Ictus previo | 1 |
| 4. Comorbilidad asociada (una o más) | 1 |
| Infarto de miocardio reciente | |
| Insuficiencia renal: Cr > 1,5mg/dl | |
| Diabetes mellitus | |
| Anemia severa | |
| Bajo riesgo | 0 |
| Riesgo moderado | 1-2 |
| Riesgo alto | ≥3 |
La introducción de los anticoagulantes orales de acción directa (ACOD) ha hecho que el grupo de pacientes susceptibles de TtoAmb pueda ampliarse. Los estudios capitales de tratamiento de la TVP y la EP —RECOVER, dabigatrán; EINSTEIN-PE post hoc38, rivaroxabán; AMPLIFY, apixabán; HOKUSAI-VTE, edoxabán—, algunos de los cuales han analizado post hoc los pronósticos en pacientes ambulatorios con PE estratificados por PESI/sPESI, han mostrado su eficacia y su seguridad frente a warfarina, y con menor riesgo de sangrado en el tratamiento de TVP/EP durante 6meses39-41. Todo ello llevó a las GPC2,21,22 a recomendar los ACOD con preferencia a fármacos antagonistas de la vitaminaK (AVK) en el tratamiento de la ETV. Estudios recientes han explorado directamente la posibilidad del TtoAmb con estos fármacos en EP. Los estudios con rivaroxabán MERCURY-PE y, sobre todo, HOT-PE (525 pacientes; mortalidad: 0,6%; hemorragias graves: 1,2% a los 90días)42 han demostrado la seguridad del TtoAmb (o alta precoz en 48h) en EP de bajo riesgo.
En resumen, pues, las opciones para el TtoAmb, una vez estratificados los pacientes de EP de bajo riesgo, son:
- 1.
Heparina de bajo peso molecular (HBPM) o fondaparinux, preferentemente en dosis única durante al menos 3meses.
- 2.
HBPM e iniciación de AVK con cambio a estos a los 7-10días, según las cifras de INR.
- 3.
HBPM ≥7días y paso a ACOD a partir de estos días con dabigatrán (150mg/12h) o edoxabán (60mg/24h).
- 4.
ACOD de inicio con apixabán (7días: 10mg/12h y luego 5mg/24h) o rivaroxabán (21días: 15mg/12h y luego 20mg/24h).
Sin embargo, resulta pertinente destacar que un inconveniente que debe superarse en España es la falta de financiación actual de los ACOD en estos procesos por el SNS.
Educación de los pacientesEl TtoAmb tras el diagnóstico de la ETV exige la educación del paciente y la coordinación entre niveles asistenciales que deben seguir su evolución. Ya hay estudios que demuestran que la implicación de equipos multidisciplinarios en la educación y seguimiento de la EP incrementa los números de TtoAmb6,43. La administración oral de los ACOD facilita esta labor y las GPC lo recomiendan (evidenciaIB)2. Se ensayan también con éxito sistemas electrónicos integrados que apoyan la posibilidad y la seguridad del TtoAmb de la EP43.
Es recomendable, pues, que el médico que propone tal tratamiento haga las siguientes comprobaciones:
El paciente entiende la importancia del tratamiento y él o un responsable cercano realizan correctamente las técnicas de autoadministración de HBPM o recibe la dosis correcta de AVK o ACOD. Puede proporcionarse material explicativo.
Es capaz de comprender y presumiblemente identificar posibles complicaciones de su enfermedad y/o derivadas del tratamiento (hemorragias, progresión de la ETV, síntomas de EP, molestias digestivas en el caso de ACOD, etc.).
Sería deseable recabar el consentimiento informado de que accede a dicho TtoAmb y de que ha recibido las instrucciones pertinentes6,22.
Seguimiento de los pacientes4En las instrucciones a pacientes deben hacerse constar claramente las siguientes circunstancias: a)determinar, según las posibilidades organizativas, quién seguirá al paciente: atención primaria, unidades de HADO, consultas externas de hospital u otros dispositivos sanitarios; b)en cualquier caso se elaborará un informe explícito para que sea posible monitorizar posibles complicaciones; c)realizar una instrucción específica en esta patología del personal de enfermería; d)programar, en su caso, las visitas al domicilio o en el hospital. En este sentido, en varias comunidades autónomas (p.ej., Galicia) funciona un servicio de llamada a las 72h posthospitalización que puede integrarse en este seguimiento. El facultativo o el equipo de enfermería podrán evaluar la situación, y en pacientes o cuidadores responsables puede bastar el contacto telefónico cada 2-3días para detectar posibles vicisitudes. En las visitas se atenderá a las posibles complicaciones de la anticoagulación o de la propia enfermedad. Las GPC2,22 recomiendan que el seguimiento lo efectúen equipos con especial interés en estos procesos.
Se supervisará, así mismo, en su caso, el tránsito de HBPM a AVK y su posterior control mediante el INR, con plan específico de instrucciones. El tratamiento con AVK puede iniciarse al mismo tiempo del diagnóstico de la ETV, junto con las HBPM con dosis idénticas a las utilizadas en el hospital. En estos casos el control deberá realizarse cada 2días y suspender la HBPM cuando el INR sea >2 durante al menos 2-3días consecutivos. También, el AVK puede iniciarse 5-7días después del tratamiento con HBPM cuando el paciente acude a las consultas externas. En este sentido pueden simplificarse los controles, permitiendo el espaciamiento cada 12semanas cuando el INR es estable2. En el caso de los ACOD se aconseja la valoración del paciente cuando se inicien estos (>7días tras la HBPM en dabigatrán y edoxabán) o en el momento del cambio de dosis (7días con apixabán o 21 con rivaroxabán). La anticoagulación se mantendrá como mínimo 3meses, y al cabo de este tiempo se reevaluará la conveniencia de una anticoagulación extendida.
Facilitación de accesibilidad al hospitala) Debe determinarse claramente el proceso de actuación en caso de complicaciones: teléfono de localización de HADO, acudir a urgencias si hemorragias graves, etc. b)Sería conveniente facilitar una forma de contacto con servicios de urgencia hospitalarios y extrahospitalarios. c)En el caso de ACOD, garantizar la existencia de un protocolo de actuación para la reversión de anticoagulación en caso necesario.
Satisfacción, calidad de vida y coste-efectividad del tratamiento ambulatorioResulta evidente que, garantizada la seguridad y la efectividad de los tratamientos, estos deben hacerse de forma ambulatoria44,45. Así, tanto los estudios que examinan el beneficio en cuanto a calidad de vida —además del ahorro de costes, estimados en cerca de 3.000 dólares/paciente)46— como las preferencias mostradas por los pacientes se decantan mayoritariamente por el TtoAmb (hasta el 89% en algunos estudios)6. Así mismo, se dispone de análisis de coste-efectividad favorables para el tratamiento de TVP/EP con ACOD47.
ConclusionesAlbert Einstein padeció una TVP en 1952, cuando contaba 73años. El genial físico, que sentía una profunda desconfianza hacia los médicos y sus diagnósticos —solo se fiaba de los post mortem—, se negó a ser hospitalizado e insistió en un tratamiento en su domicilio de Princeton48. Hoy, cerca de 70años después de aquel evento, la seguridad y la eficacia de los tratamientos actuales permiten alcanzar el deseo del científico, que coincide con la preferencia de muchos pacientes actuales. Por ello debe insistirse en las estrategias que garanticen la opción domiciliaria, y siempre que se confirme que su riesgo de muerte o de complicaciones sea bajo, no haya comorbilidades o condiciones agravantes que aconsejen la hospitalización y se observe un apropiado seguimiento y tratamiento.
Nota al suplementoEste artículo forma parte del suplemento «Protocolos de manejo de la enfermedad tromboembólica venosa. Actualización 2020», que cuenta con la colaboración de Laboratorios Rovi para la impresión y difusión del suplemento.