La hemorragia digestiva alta (HDA) es una patología frecuente que origina una gran morbilidad y coste para el sistema sanitario. Diversos estudios epidemiológicos sitúan su incidencia en 60-170 casos por 100.000 habitantes y año 1-3. La causa más frecuente de sangrado digestivo alto es la úlcera péptica, con alrededor del 40% de los casos, seguida de la hemorragia por varices esofagogástricas 2,4.
El principal reto que se presenta ante el paciente con HDA por úlcera péptica sigue siendo reducir la tasa de mortalidad, que se mantiene alrededor del 10%, a pesar de los avances en el tratamiento producidos en los últimos años 5. Varios factores se han relacionado con la mortalidad por HDA, como la edad, el estado de shock, la comorbilidad, los estigmas endoscópicos de sangrado reciente y la recidiva hemorrágica 6. Esta última, que se estima que ocurre en un 15%-20% de los casos, a pesar de un adecuado tratamiento endoscópico 7, se asocia a una mortalidad de aproximadamente del 30% 8. Debido a ello se ha puesto interés en identificar a los pacientes que tienen un mayor riesgo de resangrado y en tratar el episodio inicial de HDA de una forma suficientemente contundente, capaz de prevenir la recidiva hemorrágica.
Existe cierta controversia respecto al papel de los inhibidores de la bomba de protones (IBP) en el tratamiento de la HDA por ulcus péptico, habiendo sido el omeprazol el más estudiado, prácticamente en exclusiva. La publicación de un amplio estudio aleatorizado que comparaba este fármaco con placebo para el tratamiento de pacientes con HDA no varicosa de cualquier etiología, en el que no se encontró diferencias en las tasas de resangrado y de mortalidad 9, unido al coste de este medicamento, indujo cierta reticencia para su implantación generalizada en el tratamiento de esta patología. En una revisión publicada hace algunos años se indicaba que el omeprazol debía usarse en la HDA por ulcus péptico simplemente para acelerar la curación de la úlcera, ya que no había evidencia que apoyara su uso para la reducción del riesgo de resangrado, de la necesidad de cirugía y de muerte 10. Sin embargo, en los últimos 5 años ha aparecido un cuerpo de evidencia que obliga a replantear la cuestión.
En este trabajo se revisan los estudios publicados que han analizado la eficacia del tratamiento con IBP en la HDA y a través de unas cuestiones que se plantean se intenta posicionar a estos fármacos en el tratamiento de la HDA por úlcera péptica. Dado que es incuestionable el uso de la endoscopia como primera línea terapéutica en la HDA, se centrará la atención en el papel del tratamiento antisecretor como coadyuvante del endoscópico. No ha sido nuestra intención hacer una revisión sistemática como la realizada por otros 11, sino simplemente acercarnos a la evidencia científica existente relativa a la HDA por úlcera péptica sobre la que basar nuestra práctica clínica.
¿Es eficaz la terapéutica endoscópica para prevenir el resangrado?
Durante la década de los setenta el papel de la endoscopia fue meramente diagnóstico. En ese momento se definieron las características morfológicas de la úlcera que permitían clasificar a los pacientes según el riesgo de resangrado: los pacientes con coágulos adheridos al lecho ulceroso tienen un riesgo del 20%-30%, mientras que los pacientes con vaso visible o sangrado activo tienen el mayor riesgo de resangrado (40%-50%) 12.
El desarrollo de la terapéutica endoscópica a partir de la década de los ochenta ha sido el avance más importante que se ha producido hasta el momento en el tratamiento de la HDA por úlcera péptica. La eficacia de esta modalidad terapéutica se hizo patente en un metaanálisis de 30 ensayos clínicos aleatorizados que comparaban tratamiento endoscópico (térmico o de inyección) con tratamiento médico 7. La odds ratio (OR) fue de 0,38 (IC 95%: 0,32-0,45) para recidiva hemorrágica y de 0,55 (IC 95%: 0,40-0,76) para mortalidad en pacientes que recibieron terapéutica endoscópica respecto al grupo control. El tratamiento endoscópico también disminuyó la necesidad de cirugía (OR: 0,36; IC 95%: 0,28-0,45). Estudios posteriores han confirmado estos datos, mostrando cómo los pacientes tratados con cualquier método endoscópico tienen menor tasa de resangrado y menos necesidad de transfusiones y de cirugía urgente 13. En general se puede considerar que no hay diferencias entre los métodos de inyección (epinefrina o adrenalina junto con polidocanol) y los métodos térmicos (sonda de calor) en cuanto a tasas de resangrado 14,15. Recientemente se ha comparado el uso de hemoclips con la inyección de epinefrina con una tasa de resangrado aparentemente inferior para los clips (2,4% frente a 14,6%), pero los resultados todavía tienen el cariz de preliminares 16,17. La efectividad de la terapéutica endoscópica es incontrovertible, pero no anula el riesgo de recidiva hemorrágica que oscila entre el 15% y el 30%, estando la mayor tasa durante las primeras 72 horas 18. Parece, por tanto, que se necesita algo más que sea capaz de reducir en mayor proporción este riesgo de hemorragia. Como se verá, la solución puede estar en una inhibición potente de la secreción ácida gástrica.
¿Es necesario realizar una intensa supresión ácida gástrica?
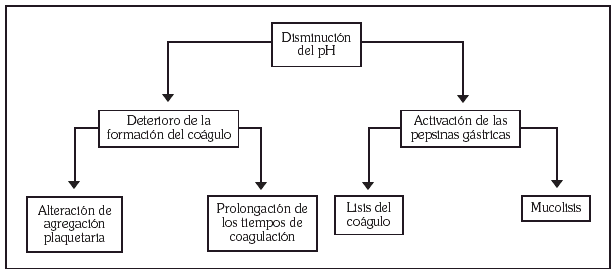
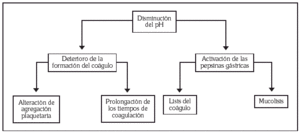
Diversos estudios in vitro indican que el ácido deteriora de forma importante los mecanismos hemostáticos y produce la digestión enzimática del coágulo (fig. 1). Cuando una úlcera lesiona un vaso sanguíneo las plaquetas se adhieren a la membrana basal y liberan una serie de agentes que activan su agregación conduciendo a la formación de un trombo plaquetar. Este trombo primario dura unas horas, pero debe completarse con un coágulo de fibrina para ser plenamente eficaz. Estas dos fases de formación del coágulo se ven muy alteradas por el ácido gástrico. La agregación plaquetaria es muy dependiente de la acidez del medio, de tal manera que a valores de pH de 5,9 está prácticamente abolida. Por otra parte, un pH de 6,5 es capaz de prolongar el tiempo de protrombina y el tiempo parcial de tromboplastina activada un 50% respecto a un pH de 7,4 19.
Fig. 1. Efecto del ácido gástrico en la hemostasis de la úlcera sangrante.
El ácido gástrico produce un aumento en la capacidad fibrinolítica in vitro, disminuyendo el tiempo de lisis del coágulo 20,21. Este efecto parece deberse a la activación de la pepsina más que a una acción directa del ácido sobre el coágulo. La actividad de la pepsina es máxima a un pH de 1,6, con un rango que va entre un pH de 1 y de 4, de tal manera que la elevación del pH por encima de 4 suprime casi completamente su actividad lítica 22. Recientemente, Vreeburg et al 23 han demostrado un aumento de la actividad fibrinolítica en muestras de mucosa gástrica de pacientes con úlcera péptica sangrante y una mejoría de los parámetros de fibrinolisis a las 24 horas de tratamiento antisecretor. Uno de los mecanismos protectores de la mucosa gastroduodenal es la capa de moco, que aisla a la mucosa del ácido clorhídrico. Estudios in vitro han demostrado que la pepsina puede disolver esta barrera y que pH superiores a 5 inactivan la pepsina reduciendo al mínimo la actividad mucolítica 24. En definitiva, el ácido gástrico es capaz tanto de deteriorar los mecanismos de formación del coágulo como de favorecer su destrucción. Por tanto parece racional intentar mantener un pH superior a 5 en los pacientes con HDA por ulcus péptico durante el tiempo necesario para la estabilización del coágulo.
¿Los antagonistas H2 consiguen una antisecreción adecuada?
Estudios in vitro que han analizado el efecto de los antagonistas H2 sobre el pH intragástrico ponen de manifiesto algunas limitaciones de importancia de este grupo farmacológico para el tratamiento médico de la HDA por ulcus péptico. En primer lugar, aun administrados en infusión continua, no parecen asegurar un pH gástrico por encima de 4 durante más de las dos terceras partes del día 25. En segundo lugar, experiencias realizadas con ranitidina han mostrado que cuando la administración es en forma de bolos intravenosos se producen grandes fluctuaciones de los valores de pH gástrico, con períodos en que es inferior a 4 26. La taquifilaxia es otro problema de estos fármacos; se ha demostrado una pérdida de eficacia en la actividad antisecretora con dosis repetidas, tanto orales como intravenosas. Este fenómeno de tolerancia se ha detectado incluso al administrar dosis intravenosas en pacientes que habían tomado previamente ranitidina oral 27. Estas limitaciones pueden ser en parte responsables de la falta de eficacia terapéutica de los antagonistas H2 en los ensayos publicados.
En un metaanálisis realizado en 1985 el tratamiento con cimetidina o ranitidina intravenosa resultó ineficaz para reducir significativamente las tasas de resangrado, de cirugía y la mortalidad 28. Sin embargo, los resultados deben tomarse con precaución, ya que las muestras de pacientes de los ensayos incluidos eran relativamente pequeñas y la incidencia global de complicaciones era baja. Un estudio multicéntrico irlandés realizado con posterioridad con más de 1.000 pacientes, utilizando famotidina en bolo intravenoso seguida de una perfusión continua durante tres días, tampoco encontró disminución de las tasas de resangrado, de necesidad de cirugía y de mortalidad 29. Sin embargo, en ese estudio no se realizó terapéutica endoscópica. Recientemente se ha publicado un nuevo metaanálisis que confirma la ineficacia de los antagonistas H2 en el tratamiento de la úlcera duodenal sangrante, aunque encuentra cierto efecto en la reducción de las tasas de resangrado, de cirugía y de muerte en úlcera gástrica 30.
Es importante constatar que un análisis de conjunto de los estudios publicados pone de manifiesto problemas de diseño que podrían enmascarar algún resultado más alentador, como son el escaso número de pacientes incluidos, la heterogeneidad de los mismos en cuanto a riesgo de resangrado y el hecho de no haber investigado si el aumento del pH intragástrico alcanzó valores adecuados. No obstante, hay argumentos para sospechar que una causa importante de la relativa falta de eficacia de los antagonistas H2 sea el fenómeno de la taquifilaxia o tolerancia a dosis repetidas, que hace perder efecto antisecretor a estos fármacos después de las 12-24 horas de iniciado el tratamiento.
¿Es más adecuada la inhibición ácida con IBP?
Los IBP inhiben la secreción ácida gástrica mediante una unión covalente e irreversible con la bomba de protones de la célula parietal. De esta manera se necesita la síntesis de nuevas bombas de protones para que la célula parietal vuelva a restaurar la secreción del ácido. Diversos estudios han evaluado el efecto de los IBP en administración intravenosa sobre el pH intragástrico con resultados bastante heterogéneos, acorde con las diferencias que existen en su diseño, tanto en cuanto a los casos incluidos (pacientes con úlcera, individuos normales) como al régimen de administración del fármaco (bolo, perfusión continua) 31-35. En general, la supresión ácida es mejor en pacientes con úlcera duodenal que en individuos normales, y en perfusión continua que en bolos sucesivos. Parece ser que con la perfusión continua se compensa la variación interindividual en la masa de células parietales y la activación circadiana de estas células por el efecto de la acetilcolina, lo que permite asegurar un pH superior a 4 en alrededor del 90% del día prácticamente en todos los individuos. En un estudio dosis-respuesta que comparaba diversos regímenes de omeprazol intravenoso se observó que la mejor pauta, entre las ensayadas, para reducir la secreción ácida gástrica era un bolo inicial de 80 mg seguido de una perfusión continua a 8 mg/h. Esa dosificación fue capaz de aumentar el pH gástrico a más de 6 en 20 minutos y mantenerlo así durante más del 80% de un período de 24 horas 36. Estudios en voluntarios sanos parecen confirmar la eficacia de esa pauta 37. Un trabajo reciente realizado en pacientes ingresados en una unidad de cuidados intensivos mostró que la administración de un bolo seguida de la infusión continua era más eficaz que la administración en bolos repetidos para mantener el pH gástrico por encima de 6 más allá de las primeras 12 horas 38. Por último, varios estudios han comparado antagonistas H2 y omeprazol en cuanto a la capacidad antisecretora midiendo el pH intragástrico. En ellos se ha demostrado la superioridad del IBP, sobre todo en infusión continua, para mantener un pH intragástrico mayor de 6, fundamentalmente a partir de las 12 horas de infusión 37,39,40.
La mayor capacidad antisecretora del IBP parece reflejarse en los resultados terapéuticos. Un metaanálisis publicado recientemente que recoge los ensayos clínicos que han comparado omeprazol con antagonistas H2 demuestra, con las reservas debidas a la heterogeneidad de los estudios incluidos, que el omeprazol es más eficaz en la disminución de las tasas de resangrado, especialmente en los pacientes con signos endoscópicos de riesgo, aunque las diferencias fueron menos evidentes cuando se había realizado tratamiento endoscópico adyuvante 41.
¿Han demostrado los IBP eficacia terapéutica?
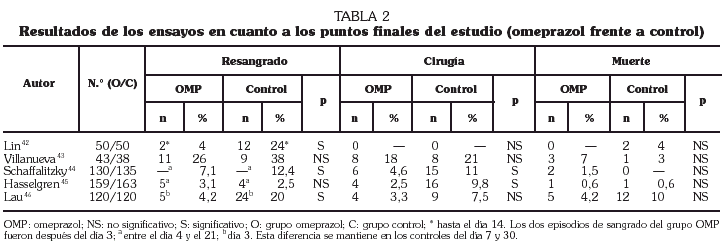
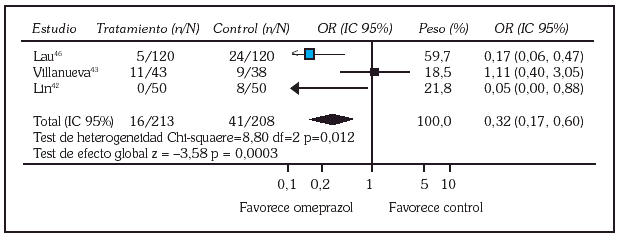
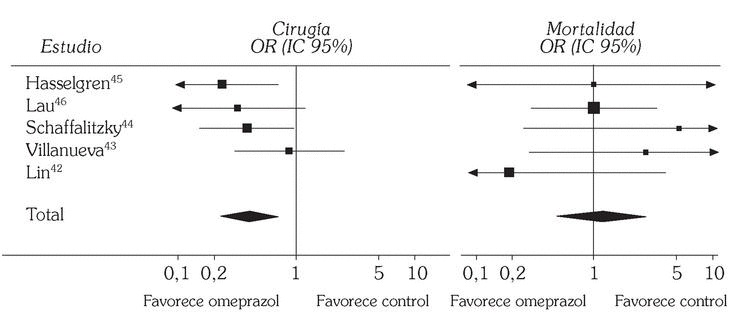
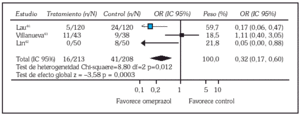
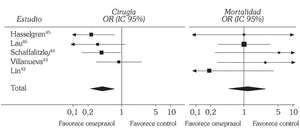
Realmente la información se concreta, por ahora, a omeprazol. Debido a que ya está estandarizada la aplicación de tratamiento endoscópico en el manejo de la HDA por ulcus péptico hay que centrarse en los estudios que incluyen esa modalidad terapéutica. Hasta el momento se localizan 5 ensayos controlados aleatorizados publicados en lengua inglesa que abordan esta cuestión administrando omeprazol por vía intravenosa. Dos comparan omeprazol con un antagonista H242,43, mientras que los otros tres lo comparan con placebo 44-46. En cuanto a la modalidad terapéutica endoscópica escogida, un estudio utilizó sonda de calor o electrocoagulación multipolar 42, otro técnicas de inyección 43, dos terapia de inyección, sonda de calor o coagulación multipolar 44,45 y otro usó tanto técnicas de inyección como de termocoagulación 46. Los puntos finales de los ensayos y objeto de la evaluación fueron las tasas de resangrado, de cirugía y de mortalidad (tabla 1). Hemos hecho una valoración conjunta de estos estudios utilizando técnicas de metaanálisis mediante el programa Review Manager 4.1 proporcionado por la Colaboración Cochrane 11. Los resultados individuales se muestran en la tabla 2 y el resultado global de los 5 estudios en cuanto a los tres puntos finales en las figuras 2 y 3. De un análisis global parece inferirse una menor tasa de resangrado y de necesidad de cirugía en el grupo que recibió omeprazol, mientras que no se aprecian diferencias en cuanto a la tasa de mortalidad. Sin embargo, un análisis más detallado revela que los resultados son bastante heterogéneos, situación que se pone especialmente de manifiesto al evaluar la tasa de resangrado donde el test de heterogeneidad alcanza significación estadística (fig. 2).
Fig. 2. Comparación entre las tasas de resangrado de los tres estudios que las evalúan (omeprazol frente a control).
Fig. 3. Comparación de las tasas de cirugía y mortalidad de los estudios incluidos (omeprazol frente a control).
También se ha investigado la eficacia de la administración oral de omeprazol. Un estudio inicial realizado en pacientes con HDA por úlcera péptica mostró que la administración de altas dosis de omeprazol oral (40 mg/12 h) disminuía el resangrando en comparación con placebo. Este estudio tenía limitaciones en su diseño que hacía difícil extrapolar sus resultados, como son el hecho de que no se realizara terapia endoscópica, lo que podría aumentar las tasas encontradas de resangrado y cirugía. Además, los pacientes incluidos eran relativamente jóvenes y por tanto con un menor número de enfermedades concomitantes respecto a los pacientes occidentales 47. Recientemente, Javid et al 48 han difundido los resultados de un estudio aleatorizado y controlado con placebo para determinar si altas dosis de omeprazol oral (40 mg/12 h) administrado durante 5 días aportaba algún beneficio al tratamiento endoscópico (inyección de adrenalina y polidocanol) en pacientes con HDA por úlcera péptica con hemorragia activa, vaso visible o coágulo adherido. En este estudio se observó que el tratamiento con omeprazol redujo significativamente el resangrado, la necesidad de transfusión y la estancia hospitalaria, hubo una tendencia a menor necesidad de cirugía y no se encontraron diferencias en la mortalidad. Estos resultados pueden tener una importante repercusión en la práctica clínica en la medida que no sólo reafirman la eficacia del IBP como tratamiento coadyuvante del endoscópico, sino también porque abren la posibilidad del tratamiento oral.
¿Hay suficiente evidencia para recomendar el uso de IBP?
Como vemos, de la información disponible, aunque los resultados tanto individuales como globales no son totalmente concluyentes, se puede inferir que existen datos que sustentan la recomendación de asociar omeprazol al tratamiento endosdópico de los pacientes con HDA por úlcera péptica. No obstante, todavía quedan puntos de incertidumbre ciertamente producidos por limitaciones en el diseño de los estudios. En este sentido se debe tomar en consideración, en primer lugar, que se está analizando la eficacia del IBP en disminuir las tasa de resangrado, de cirugía y de muerte, administrado además de la terapia endoscópica, que es la única que se ha mostrado efectiva por sí misma. Como ha demostrado el estudio de Lau et al 46 se necesita un diseño riguroso y un buen tamaño muestral para apreciar diferencias que pueden ser sutiles. Y es que el problema fundamental de los estudios disponibles es su diseño, que los hace difícilmente comparables entre sí. Como se ha comentado antes, dos de los 5 estudios que investigaban omeprazol intravenoso lo comparaban frente a antagonistas H2 y no frente a placebo, lo que podría haber atenuado algo el efecto beneficioso del IBP 42,43. En alguno de ellos la dosis de omeprazol era menor a 8 mg/h 43, que parece ser la más eficaz para mantener un pH gástrico elevado. Dos de los 5 estudios no eran doble ciego 42,43. En dos estudios escandinavos 44,45 el cálculo del tamaño de la muestra se basó en la diferencia de unidades de sangre transfundidas en ambas ramas de tratamiento y no en la tasa de resangrado. El estudio de Villanueva et al 43, que es el único que no detecta una menor tasa de resangrado en la rama del omeprazol, es también el de menor tamaño muestral. Pero quizá el mayor problema de diseño de estos estudios es la heterogeneidad de los pacientes incluidos. Ya se ha comentado que se puede estratificar a los pacientes en mayor o menor riesgo de recidiva hemorrágica según los estigmas de sangrado de la úlcera. Los dos únicos estudios que incluyen sólo pacientes con un mayor riesgo de recidiva hemorrágica (sangrado activo o vaso visible no sangrante) son precisamente los que muestran menor tasa de resangrado en el brazo del omeprazol 42,46. Los pacientes que no tienen sangrado activo, vaso visible ni coágulo adherido tienen un riesgo de resangrado muy bajo que no es probable que ningún tratamiento pueda reducir todavía más 49. La inclusión en un estudio de este grupo de bajo riesgo para el que algunos autores recomiendan incluso el alta hospitalaria precoz 50 puede a la hora de realizar el análisis global enmascarar el potencial efecto del omeprazol en los pacientes con mayor riesgo de recidiva hemorrágica. De hecho, a medida que gana en calidad el diseño del estudio se observa mayor beneficio terapéutico del IBP. Así, en el estudio de Lau et al 46 con una muestra suficiente, calculada a priori, y con un subgrupo de pacientes con riesgo de resangrado, sí que se puso de manifiesto el beneficio de asociar omeprazol al tratamiento endoscópico de la úlcera péptica sangrante para la prevención de la recidiva hemorrágica. Sin embargo, a pesar de la mejora en el diseño, este estudio tampoco ha sido capaz de demostrar efecto positivo sobre el punto final más importante: la mortalidad. Probablemente ese objetivo sea imposible de cumplir ya que para ello sería necesario diseñar un estudio con un tamaño muestral muy grande, comparable quizás en su magnitud a estudios clásicos de otras especialidades. Además es probable que la mayoría de las muertes sean secundarias más a la comorbilidad que tienen muchos de estos pacientes que al propio episodio de sangrado 6, y que sea la mejora en los tratamientos de soporte y en el manejo de las complicaciones, más que el omeprazol, lo que consiga disminuir la mortalidad.
El estudio de Javid et al 48 con omeprazol oral y un diseño impecable refuerza la importancia terapéutica del IBP como coadyuvante del tratamiento endoscópico, pero tiene una limitación que puede tener importancia a la hora de extrapolar sus resultados a la práctica clínica general. Es el ámbito donde se ha realizado: población india, en la que se sabe que la capacidad secretora ácida gástrica es inferior a la occidental por tener menor masa de células parietales 51, y ello deja la incertidumbre de si ese régimen terapéutico obtendría iguales resultados en población occidental. Además, al igual que en estudio de Khuroo et al 47 la edad media de los pacientes incluidos y el número de comorbilidades era menor de lo que sería esperable en nuestro medio.
¿Se puede individualizar el tratamiento con IBP?
El factor pronóstico más importante para predecir el resangrado de una úlcera péptica es el aspecto endoscópico en el momento del diagnóstico. Así, la presencia de hemorragia activa o de un vaso visible conlleva un riesgo de resangrado muy elevado 52. En este subgrupo de pacientes sería racional indicar tratamiento con omeprazol. Otros encuentran mayor riesgo en las úlceras de más de 2 cm y en las situadas en el estómago 53. Además de los factores endoscópicos hay otros que pueden incrementar el riesgo de mortalidad y resangrado. Varios estudios detectan un aumento de riesgo en pacientes mayores de 60 años 2,54. También la presencia de una hipovolemia grave en el momento del ingreso se asocia con un incremento del riesgo, que en el caso de la mortalidad puede ser superior al 30% 55,56. La mortalidad es mayor en los pacientes con comorbilidad, como patología del sistema nervioso central, insuficiencia hepática, enfermedades pulmonares o cardíacas, insuficiencia renal y cáncer 57,58. Por último, también tienen un mayor riesgo de mortalidad los pacientes que sufren un episodio de HDA mientras están ingresados por otra causa 2,55.
Dado que la consideración de todos estos factores endoscópicos y clínicos puede hacer bastante compleja la estratificación del riesgo de manera individual, se han diseñado métodos de puntuación predictivos del riesgo de resangrado y de muerte. El más popular ha sido desarrollado en el Reino Unido por Rockall et al 6 y posteriormente validado en otras poblaciones como la holandesa 59. Este sistema, aplicable para toda HDA de origen no varicoso, incluye la edad, la presencia de shock al ingreso y la comorbilidad, además de la apariencia endoscópica para calcular un riesgo de resangrado y de muerte. Otros sistemas menos difundidos, como el de Blatchford et al 60 o el de Baylor 61, utilizan parámetros parecidos. La consideración de estos factores clínicos podría facilitar la individualización del tratamiento. La decisión de prescindir del tratamiento antisecretor potente podría ser racional en los pacientes sin estigmas de sangrado reciente, sin hipotensión al ingreso y con una edad inferior a 60 años. En cambio sería racional considerarlo en aquellos con estigmas de sangrado reciente, shock al ingreso y edad superior a 60 años. Entre estos dos extremos la pauta antisecretora a elegir variará según las características de cada caso, primando mucho en la decisión, a nuestro entender, los criterios endoscópicos porque se asocian bien con los riesgos. En el caso de utilizar sistemas de puntuación como el de Rockall et al 6 quizá los pacientes con más de 5 puntos serían subsidiarios de pauta continua con omeprazol.
Bajo esta perspectiva se puede estimar que se utilizaría la pauta de perfusión continua de omeprazol en alrededor de un tercio de los pacientes. Por ejemplo, en el trabajo de Lau et al 46 que sólo tenía en cuenta los pacientes con sangrado activo o con vaso visible, que son los criterios endoscópicos de mayor riesgo de resangrado, de todos los pacientes que acudieron con úlcera sangrante fueron finalmente incluidos el 36%. En la serie original de Rockall 3 el 37% de los pacientes evaluados tenían una puntuación igual o mayor a 5 y hubieran sido, por tanto, subsidiarios de tratamiento antisecretor potente.
¿Es eficiente el tratamiento con IBP?
La HDA supone un gran coste para el sistema sanitario, tanto por su frecuencia como por la cantidad y variedad de recursos que consume. Un cálculo preciso de costes es difícil de estimar y depende en gran manera del contexto en que se sitúa. Así, un estudio canadiense comunicó un coste de 1.883 dólares americanos por paciente 62, mientras que estudios estadounidenses sitúan el coste alrededor de los 5.000 dólares por paciente 13,63. En España conocemos un estudio de coste del tratamiento hospitalario de la HDA producida por toma de antiinflamatorios no esteroideos (AINE) que lo situó alrededor de los 2.611 euros 64, pero no se especificaron los tratamientos administrados ni el coste de cada modalidad. Otro estudio más general calculó un coste por paciente del tratamiento de las complicaciones gastrointestinales por AINE, la mayoría, pero no exclusivamente HDA, de 1.879 euros 65. Quizás la diferencia entre EE.UU. y España se deba en parte al alto coste que en el primer país tienen las técnicas endoscópicas 66,67. No conocemos publicaciones que aborden específicamente la influencia del uso de antisecretores en el coste global de la hospitalización por HDA. Tan sólo en el estudio de Ballesteros et al 26, que comparaba ranitidina en bolo intravenoso y en perfusión continua para el tratamiento de la HDA, se calculó un coste de estas pautas entre 79 y 128 dólares diarios. Por tanto, los comentarios que haremos a continuación no pueden pasar de ser puramente especulativos.
La falta de estudios farmacoeconómicos es quizás uno de los principales argumentos en contra de la implantación generalizada del IBP en la HDA ya que, comparando directamente unidades de medicación, su precio es muy superior al de los antagonistas H2. Sin embargo, el proceso asistencial de la HDA consta de muchas otras intervenciones que influyen en su coste final 64, por lo que el análisis no puede ser tan simplista. De la misma forma que la endoscopia terapéutica ha demostrado un abaratamiento del proceso HDA mediante la disminución de la tasa de resangrado y de la necesidad de cirugía 67, hay razones para suponer que el IBP usado en hemorragias graves sea también capaz de disminuir el coste global de todo el proceso. Tomando como referencia información existente con omeprazol podemos hacernos una idea del rendimiento que puede tener su indicación en el contexto clínico adecuado si consideramos que el NNT (número necesario para tratar) para evitar un episodio de resangrado calculado a partir de los datos del estudio de Lau et al 46 es tan sólo de 4 (IC 95% 4-14). Esta cifra es inferior, por ejemplo, al NNT del tratamiento erradicador de Helicobacter pylori en pacientes con úlcera péptica sangrante para evitar la recidiva de la hemorragia 68.
Conclusión
En la práctica clínica y a la luz de la evidencia aportada en los últimos años podemos concluir que para el tratamiento de la HDA en el subgrupo de pacientes con elevado riesgo de resangrado, además de la hemostasia endoscópica, es racional indicar tratamiento intensivo con omeprazol a dosis de 80 mg intravenoso en bolo seguido de una perfusión de 8 mg/h, que debe mantenerse 72 horas. En aquellos con riesgo bajo de resangrado puede ser suficiente una dosis de 20-40 mg de omeprazol intravenoso en bolo al día, con un inicio precoz de la alimentación oral. En el caso de pacientes con un riesgo casi nulo de resangrado puede ser suficiente la administración oral de omeprazol con alta hospitalaria precoz. Aunque es probable que la reducción de las necesidades transfusionales y de cirugía sea suficiente para compensar los costes que supone la aplicación de esta pauta, se necesitan estudios de coste-beneficio para demostrar también su eficiencia en la práctica clínica diaria.