La asociación de obesidad abdominal, resistencia a la insulina, dislipemia e hipertensión arterial fueron descritas por primera vez en el año 1988 por Reaven, acuñándose el término de síndrome metabólico o síndrome X para referirse a dicha asociación 1. Posteriormente, en el año 2001 el síndrome metabólico fue definido de manera precisa por el National Colesterol Education Program Adult Treatment Panel III (ATP III) 2. Si bien dicha definición ha sido la más usada hasta la fecha, otras instituciones, como la Organización Mundial de la Salud (OMS) 3 y, más recientemente, la International Diabetes Federation (IDF) 4 han elaborado sus propias clasificaciones para identificar el síndrome metabólico (tabla 1).
Aunque los criterios de las anteriores definiciones no son coincidentes, lo que sí ha quedado demostrado es que los pacientes diagnosticados de síndrome metabólico, independientemente de la definición usada, presentan una mayor prevalencia de enfermedad cardiovascular, o tienen un mayor riesgo de desarrollarla. En general, el riesgo cardiovascular de los pacientes con síndrome metabólico se ve aumentado entre un 30% y un 400% dependiendo de las definiciones usadas y las poblaciones estudiadas 5-9.
Por tanto, los objetivos primarios al establecer los criterios que definen el síndrome metabólico son la identificación de individuos con alto riesgo para desarrollar enfermedad cardiovascular y el uso de dicho diagnóstico para iniciar modificaciones en el estilo de vida y/o terapias farmacológicas dirigidas a disminuir dicho riesgo 2. No obstante, la utilidad significativa para la práctica clínica del síndrome metabólico ha sido recientemente puesta en tela de juicio 10, incluso por el propio Reaven 11. Sin embargo, pensamos que no parece adecuado, al menos por ahora, eliminar este concepto nosológico, dado que es sencillo y fácil de aplicar en la práctica clínica habitual, siempre y cuando se tengan presentes algunas recomendaciones recientemente publicadas sobre su uso 10,12,13.
Tratamiento farmacológico del síndrome metabólico
Cuando un paciente es diagnosticado de síndrome metabólico, la dieta y el ejercicio físico constituyen dos elementos terapéuticos fundamentales 2,14-17, ya que disminuyen la resistencia a la insulina y mejoran el control de cada uno de los componentes del síndrome metabólico 18.
En cuanto al tratamiento farmacológico, está claramente establecido que aquellos pacientes que tengan factores de riesgo con cifras por encima de lo actualmente aceptado como indicación de intervención (criterios diagnósticos de diabetes mellitus tipo 2, presión arterial elevada, etc.) deben recibir medicación de acuerdo con los estándares actuales 19,20. Sin embargo, dada la amplia variedad de fármacos disponibles para el tratamiento de los factores de riesgo convencionales, la elección de los mismos no siempre es fácil. De hecho, existen fármacos que pueden mejorar algunos aspectos del síndrome metabólico y empeorar otros, como ocurre, por ejemplo, con algunos diuréticos o bloqueadores β, que aunque disminuyen la presión arterial pueden empeorar el perfil metabólico de los pacientes.
Por otro lado, es interesante considerar la hipótesis sobre la posibilidad de que un determinado fármaco sea capaz de reducir el riesgo cardiovascular en los pacientes con síndrome metabólico, más allá de los efectos sobre alguno de sus componentes en particular. En este sentido se ha planteado que aquellos fármacos capaces de disminuir la resistencia a la insulina, hecho central y común en el síndrome metabólico, podrían tener un efecto beneficioso añadido sobre el mismo 21.
Fármacos que disminuyen la resistencia a la insulina a través de PPARγ
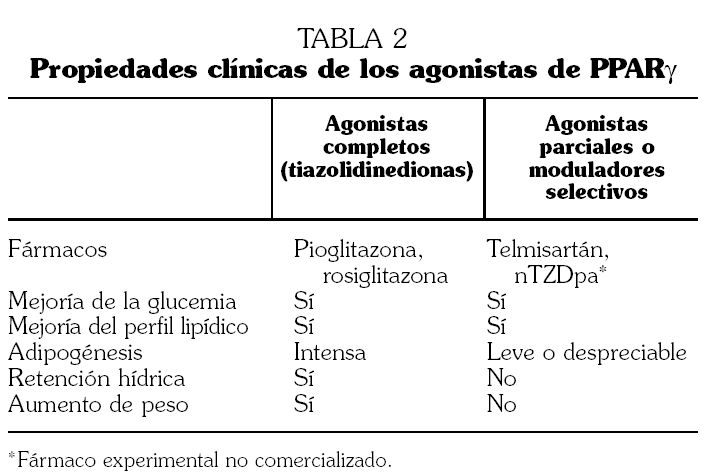
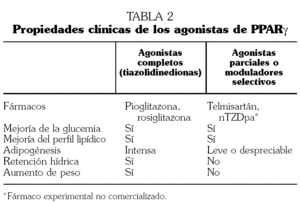
El receptor de proliferador activado de los peroxisomas tipo gamma (peroxisome proliferator-activated receptor-gamma, PPARγ) se localiza en el núcleo celular y desempeña un papel fundamental en el metabolismo de los hidratos de carbono y los lípidos 22. Se ha demostrado que determinadas mutaciones en el gen del PPARγ producen una marcada resistencia a la insulina y favorecen el desarrollo del síndrome metabólico 23. Por tanto, es razonable sugerir que aquellos fármacos que disminuyen la resistencia a la insulina a través de la activación de los PPARγ, como las tiazolidinedionas (pioglitazona y rosiglitazona), pueden ocupar una posición relevante en el tratamiento del síndrome metabólico 21.
Recientemente se ha publicado un estudio en el que se evaluó la eficacia de la pioglitazona en la reducción de los eventos cardiovasculares en pacientes diabéticos tipo 2 (estudio PROactive) 24. Este estudio aleatorizado y controlado, que incluyó a 5.238 pacientes, muchos de ellos con criterios de definición de síndrome metabólico, demostró que la adición de pioglitazona a la medicación estándar para el control de cada uno de los factores de riesgo se asoció a una reducción significativa de la mortalidad cardiovascular 24. No obstante, han aparecido algunas críticas importantes respecto a este trabajo:
1) La pioglitazona también aumentó la tasa de insuficiencia cardíaca y edemas 25,26.
2) Los pacientes asignados a este fármaco tuvieron una mayor incidencia de cáncer vesical, lo que obliga a cuestionar su uso a las dosis empleadas en dicho estudio 27.
3) Los resultados no fueron ajustados para las diferencias en hemoglobina glicada y presión arterial entre los grupos que recibieron pioglitazona y placebo, lo cual puede haber favorecido el efecto beneficioso de la pioglitazona 25,28.
4) La reducción del riesgo relativo en un 10% para el objetivo primario no fue significativa, y sólo cuando se evaluaron los resultados para el objetivo secundario (no contemplado en la presentación del protocolo inicial) el resultado fue significativo 29,30.
Además de las consideraciones anteriores, las tiazolidinedionas tienen efectos limitados sobre la presión arterial, presente en muchos pacientes diagnosticados de síndrome metabólico. Esto último, unido a que sus efectos secundarios producen retención hidrosalina, aumento de peso, edema e incluso insuficiencia cardíaca, determina que las tiazolidinedionas tengan un papel limitado en el tratamiento de pacientes con síndrome metabólico en los que la hipertensión está presente o en aquellos en los que los efectos secundarios de estos fármacos puedan agravar su situación clínica 31.
Efectos metabólicos de la interrupción del eje renina-angiotensina
En general, los fármacos actualmente usados para el tratamiento de la hipertensión arterial no se consideran eficaces en el síndrome metabólico, circunstancia que no sorprende dado que la mayoría de los hipotensores se desarrollaron antes de establecer la definición de síndrome metabólico 32. Posteriormente a su definición, se han introducido los inhibidores de la enzima convertidora de la angiotensina (IECA) y, más recientemente, los antagonistas de los receptores de la angiotensina II (ARA II).
En los últimos años diversos estudios prospectivos con gran número de pacientes han comenzado a explorar los efectos metabólicos de los IECA, sobre todo en cuanto a disminuir el riesgo de diabetes mellitus tipo 2. Entre dichos estudios se encuentran el Heart Outcomes Prevention Evaluation (HOPE) 33 realizado con ramipril, el Antihypertensive and Lipid-Lowering Treatment to prevent Heart Attack Trial (ALLHAT) 34 con lisinopril y el CAPtopril Prevention Project (CAPPP) con captopril 35. En el primero, el ramipril disminuyó significativamente en un 3,6% el riesgo de diabetes mellitus tipo 2 frente a placebo, mientras que en los dos últimos el uso de lisinopril o captopril también disminuyó el riesgo de diabetes frente al uso de diuréticos, bloqueadores β o calcioantagonistas. Se desconoce con precisión la base biológica de este efecto metabólico de los IECA. Algunos han postulado que podrían explicarse por vías fisiológicas independientes del eje renina-angiotensina-aldosterona, como la síntesis de bradiquininas o de óxido nítrico 32.
Igualmente se han investigado los efectos metabólicos de los ARA II en ensayos clínicos recientes controlados y aleatorizados. El estudio Losartan Intervention For Endpoint reduction in hypertension (LIFE) 36 evaluó, como objetivo secundario, la incidencia de diabetes mellitus tipo 2 en 7.998 pacientes hipertensos. La incidencia fue de 1,3% en los que recibieron losartán frente a un 1,75% respecto a los que se administró atenolol. En el estudio Valsartan Antihypertensive Long-term Use Evaluation (VALUE) 37 la incidencia de diabetes mellitus también fue menor en los pacientes tratados con valsartán frente a los que recibieron amlodipino. Asimismo, en el estudio Antihypertensive treatment and Lipid Profile In a North Sweden efficacy Evaluation (ALPINE) 38 los pacientes que recibieron hidroclorotiacida empeoraron su perfil metabólico frente a aquellos tratados con candesartán. Sin embargo, estos trabajos adolecen de la limitación de que no se comparan frente a placebo, por lo que surge la duda sobre si los ARA II son capaces realmente de prevenir la aparición de la diabetes mellitus tipo 2 o si son «metabólicamente neutros», a diferencia de los otros fármacos antihipertensivos empleados en dichos estudios. En este sentido, otros dos trabajos que examinaron la eficacia de candesartán en la disminución de la incidencia de diabetes mellitus tipo 2 frente a placebo (Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity - Preserved trial [CHARM-P] 39 y el Study on COgnition and Prognosis in the Elderly [SCOPE] 40) han mostrado resultados contradictorios.
La mayoría de los estudios que han investigado los efectos metabólicos de los ARA II se han centrado en el uso de losartán u otros que, como el candesartán, tienen una homología estructural con aquél. Sin embargo, no todos los ARA II son estructuralmente similares. En particular, el telmisartán, un derivado no tetrazólico y altamente liposoluble, tiene unas propiedades químicas únicas que le hacen ser capaz de modular los PPARγ 41.
Fármacos moduladores selectivos de los PPARγ
El concepto de fármaco modulador selectivo de los PPARγ (Selective PPARγModulators, SPPARM), hace referencia a aquellos compuestos con capacidad de agonismo parcial de dichos receptores, a diferencia de las tiazolidinedionas (pioglitazona y rosiglitazona) que son agonistas completos 41. Dentro de este grupo de moduladores selectivos se encuentran el telmisartán 42 y el compuesto nTZDpa 43, todavía en fase experimental y no comercializado. Al actuar como agonista parcial de los PPARγ, el telmisartán es capaz de reducir la glucemia, la insulinemia y las concentraciones de triglicéridos en ratas alimentadas con dietas ricas en grasas y carbohidratos 42. Ningún otro ARA II, excepto el irbesartán a dosis muy elevadas y superiores a las farmacológicas, ha demostrado este efecto sobre la resistencia a la insulina y el perfil metabólico 44.
La activación parcial de los PPARγ que producen los SPPARM produce un beneficio similar al conseguido con los agonistas completos, en cuanto a la disminución de la resistencia a la insulina y la mejoría de la glucemia y el perfil lipídico. Además estos fármacos carecen al mismo tiempo de los efectos secundarios típicos de las tiazolidinedionas, tales como el aumento de peso, la retención hidrosalina y el cúmulo de grasa visceral (tabla 2). Por tanto, los SPPARM pueden ser una alternativa interesante en el tratamiento de los pacientes con síndrome metabólico hipertensos, o con insuficiencia cardíaca y/o riesgo de retención hidrosalina.
Por todo lo dicho hasta aquí se esperan con gran expectación los resultados de los estudios Ongoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial (ONTARGET) y Telmisartan Randomized AssessmeNt Study in ACE-iNtolerant subjects with cardiovascular Disease (TRANSCEND). Dichos estudios se encuentran actualmente en marcha (25.260 sujetos finalmente reclutados en mayo de 2003 en el ONTARGET y 5.926 sujetos finalmente reclutados en abril de 2004 en el TRANSCEND), y están diseñados para valorar los beneficios de telmisartán, asociado o no a ramipril, en la mortalidad cardiovascular y en el perfil metabólico 45. Teniendo en cuenta que estos estudios podrán valorar la eficacia de telmisartán sobre la resistencia a la insulina y otros factores de riesgo cardiovascular, será posible también conocer si dicho fármaco es eficaz en el tratamiento del síndrome metabólico.