Los síndromes crioglobulinémicos comprenden un conjunto de manifestaciones que se encuentran en diversas enfermedades y que comparten un mismo mecanismo fisiopatológico: el depósito de crioglobulinas en lechos vasculares. La presencia de crioglobulinas es criterio diagnóstico de estos síndromes por lo que es imprescindible su correcta detección y caracterización. El Grupo de Inmunoquímica de la Sociedad Española de Inmunología ha realizado una revisión exhaustiva clínica y metodológica, debido a la heterogeneidad técnica interlaboratorios, con el objetivo de proporcionar una herramienta útil y efectiva para el diagnóstico de síndromes crioglobulinémicos.
Cryoglobulinaemic syndromes include a collection of manifestations that are found in various diseases and that share a pathophysiological mechanism: cryoglobulin deposit in vascular beds. For these syndromes, the presence of cryoglobulins is a diagnostic criterion, and their correct detection and characterisation are therefore essential. The Immunochemistry Group of the Spanish Society of Immunology conducted a comprehensive clinical and methodological review, due to the interlaboratory heterogeneity in techniques, with the objective of providing a useful and effective tool for diagnosing cryoglobulinaemic syndromes.
Los síndromes crioglobulinémicos, también conocidos como vasculitis crioglobulinémicas, son trastornos asociados a procesos malignos, infecciones crónicas1,2 y/o enfermedades autoinmunes3. En este tipo de patologías existe una síntesis exacerbada de inmunoglobulinas que, en ocasiones, puede dar lugar a un subgrupo de inmunoglobulinas anómalas denominadas crioglobulinas.
Las crioglobulinas son inmunoglobulinas que precipitan de manera reversible a temperaturas inferiores a 37°C, proceso denominado crioprecipitación. Se observaron por primera vez en 1933 en un paciente con fenómeno de Raynaud4. Más tarde, en 1947 estas proteínas fueron caracterizadas como gammaglobulinas y englobadas bajo el término de crioglobulinas5.
La mera presencia de crioglobulinas en sangre define el término crioglobulinemia, mientras que la coexistencia de síntomas relacionados con las crioglobulinas es lo que define el síndrome o vasculitis crioglobulinémica6.
Las crioglobulinemias son patologías relativamente poco frecuentes, con una prevalencia de 1:100.000 personas, afectando más al sexo femenino que al masculino (ratio 3:1) y principalmente a un rango de edad de 42-52 años7,8. Afecta de forma más frecuente a la población del sur de Europa que a la del norte de Europa o de América9. La prevalencia se encuentra estrechamente asociada a la enfermedad subyacente, encontrándose un 16% de pacientes con crioglobulinas entre los afectos de síndrome de Sjögren10, un 17% en VIH11, un 25% en lupus eritematoso sistémico12 y hasta un 60% en VHC8,13. Un pequeño porcentaje de crioglobulinemias no se encuentra asociado a enfermedad, y son referidas como crioglobulinemias esenciales9,14.
En función de la enfermedad subyacente y del tipo de inmunoglobulina se han descrito 3 tipos de crioglobulinas9 (tabla 1).
Clasificación y características de las diferentes crioglobulinas
| Crioglobulina | Composición | Frecuencia | Patología asociada | Volumen | Tiempo de precipitado |
|---|---|---|---|---|---|
| Tipo I | IgM, IgG, IgA o cadenas ligeras libres monoclonal | 10-15% | Enfermedades linfoproliferativas (GMSI, MM, MW, LLC, LNH) | 30-80% del suero | Minutos-horas |
| Tipo II | IgM monoclonal+IgG policlonal | 50-60% | Infecciones virales (VHC, VHB, VIH, VEB, CMV), bacterianas y de parásitos, desórdenes AI y linfoproliferativos | 1,5-30% del suero | Horas-días |
| Tipo III | IgM e IgG policlonal | 25-30% | 0,5-1,5% del suero | 3-5 días |
AI: autoinmune; CMV: citomegalovirus; GMSI: gammapatía monoclonal de significado incierto; LLC: leucemia linfocítica crónica; LNH: linfoma no Hodgkin; MM: mieloma múltiple; MW: macroglobulinemia de Waldestrom; VEB: virus de Epstein-Barr; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
Son componentes monoclonales de tipo IgM, con menor frecuencia IgG y rara vez de tipo IgA o cadenas ligeras libres. Son las crioglobulinas que se encuentran con una menor frecuencia (10-15%)15 y se asocian a patología hematológica, principalmente a gammapatías monoclonales de significado incierto (40%) y otras alteraciones del linaje de células B, como el mieloma múltiple, macroglobulinemia de Waldestrom o leucemia linfocítica crónica16,17. Por lo general son crioglobulinemias asintomáticas, pero en algunos casos la precipitación de crioglobulinas en pequeños vasos puede generar oclusiones vasculares y, subsecuentemente, cursar con síndrome de hiperviscosidad inducido por frío6,8,18. Estas vasculitis de pequeño vaso afectan principalmente al riñón y la piel. La afectación renal, que se presenta principalmente en forma de glomerulonefritis, implica proteinuria, hematuria microscópica, creatinina elevada y/o hipertensión y es más común en las crioglobulinemias de clase IgG. Las manifestaciones en la piel incluyen púrpura, livedo reticularis, fenómeno de Raynaud, acrocianosis, necrosis o úlceras y suelen limitarse a extremidades distales (dedos, orejas, nariz) y tras exposición al frío. De forma menos frecuente puede observarse neuropatía periférica y/o artralgia16,19.
Crioglobulinas de tipo ii y iii (mixtas)Las crioglobulinas de tipo ii están constituidas por IgG policlonal y un componente monoclonal, habitualmente IgM, que presenta actividad de factor reumatoide (FR). Son las que se detectan con una mayor frecuencia (50-60% de pacientes crioglobulinémicos). Las crioglobulinas de tipo iii se componen de IgG e IgM policlonales, las segundas con actividad de FR. Se encuentran a una frecuencia intermedia a las de tipo i y ii (25-30%)15. Con la llegada de tecnología más sensible, como el inmunoblot o la electroforesis en gel de poliacrilamida en 2 dimensiones, se ha detectado un porcentaje de crioglobulinas de tipo ii que muestra una composición de IgM oligoclonal o mezcla de oligo- y policlonal. Este subgrupo podría tratarse de un estado de transición de crioglobulinemia de tipo iii a tipo ii y se han denominado crioglobulinas de tipo ii-iii14,20.
Las crioglobulinas mixtas se asocian a infecciones crónicas (principalmente las de tipo ii) y enfermedades autoinmunes (en su mayoría de tipo iii), procesos que conllevan una hiperestimulación del sistema inmune en general y de la síntesis de anticuerpos en particular. La asociación más alta se encuentra entre las crioglobulinas de tipo ii y la infección por VHC (hasta un 95%)8.
Las crioglobulinemias mixtas normalmente cursan con síntomas de vasculitis debido a la deposición en pequeños y medianos vasos de inmunocomplejos formados principalmente por inmunoglobulinas, antígeno y complemento, pero también por factores hemáticos locales. Por tanto, dadas sus características clínicas e histológicas, las crioglobulinemias mixtas se clasifican también dentro de las vasculitis sistémicas de pequeño vaso9,21. En comparación con las crioglobulinemias de tipo i, las mixtas se presentan con síntomas constitucionales como fiebre, debilidad, mialgia/artralgia y anorexia, reflejo del desorden por inmunocomplejos17. El signo más común es la púrpura de manera aislada, en casi el 90% de los pacientes; sin embargo, en un tercio de estos pacientes va acompañada de artralgia y debilidad (tríada de Meltzer)22. La enfermedad renal y la neuropatía son similares a las que acontecen en las crioglobulinemias de tipo i, aunque en estas últimas es más probable demostrar la oclusión de pequeños vasos por los agregados de crioglobulinas. Por lo general, la afectación de otros órganos además del riñón es rara, pero cuando se da es un signo que señala casi exclusivamente a una crioglobulinemia mixta17.
La sintomatología es comparable entre síndromes por crioglobulinas de tipo ii o tipo iii9, pero varía enormemente entre pacientes, desde la presencia asintomática de crioglobulinas en suero al síndrome crioglobulinémico completo.
CrioprecipitaciónEl proceso de crioprecipitación no se entiende por completo, pero se sabe que difiere entre las crioglobulinas de tipo i y las mixtas. En las primeras el componente monoclonal cristaliza y se agrega, proceso que depende de la temperatura y la concentración. De hecho, cuando la concentración es muy elevada, cierta precipitación puede ocurrir a temperatura ambiente y en pocas horas17. En las crioglobulinemias mixtas, sin embargo, la crioprecipitación ocurre en el contexto de la formación de inmunocomplejos entre las IgG e IgM y la fijación de complemento y se ve afectada por la avidez de la IgG por el antígeno23,24. En este tipo de crioglobulinemias los componentes IgG o IgM no precipitan de manera aislada, sino de forma conjunta, y se requieren periodos prolongados a baja temperatura para que ocurra dicha precipitación25.
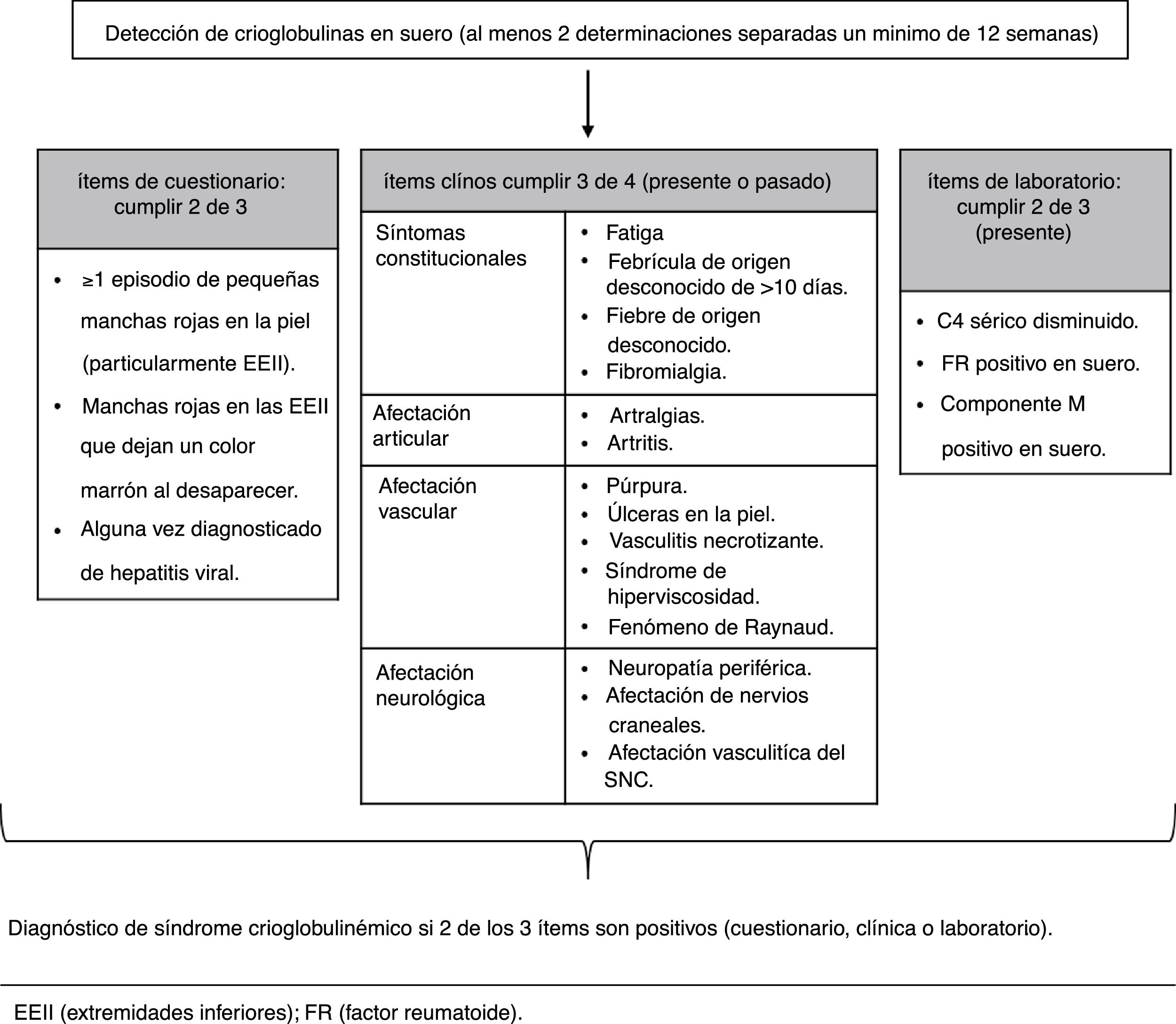
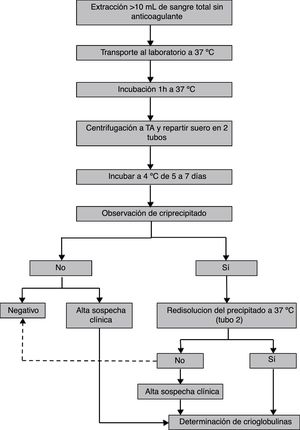
diagnóstico de crioglobulinemiasLa correcta clasificación de los pacientes es importante en la práctica clínica, así como para los estudios epidemiológicos. Para llegar al diagnóstico de enfermedad o vasculitis crioglobulinémica son necesarios la presencia de crioglobulinas en suero y el cumplimiento de una serie de criterios clínicos y de laboratorio21,26,27. En 2011 se estableció la metodología de clasificación de los síndromes crioglobulinémicos, basada fundamentalmente en la presencia de crioglobulinas en suero como criterio de inclusión18,28(fig. 1). Por tanto, es fundamental que también la detección de crioglobulinas en el laboratorio sea un procedimiento estandarizado entre centros, de manera que se obtengan resultados comparables. Se han descrito pacientes con síndrome crioglobulinémico mixto sin crioglobulinas en suero. Esto es generalmente un fenómeno transitorio debido a la amplia variabilidad en porcentaje de crioprecipitado en suero y quizás a la sensibilidad de la técnica de laboratorio empleada. En estos pacientes es necesaria la determinación reiterada de crioglobulinas para un diagnóstico correcto27.
Criterios de clasificación preliminares para los síndromes crioglobulinémicos (adaptada de De Vita et al., 201128).
La caracterización de crioglobulinas en suero está limitada por la necesidad de condiciones preanalíticas estrictas, la lectura subjetiva de resultados y la falta de criterios estandarizados.
La mera detección de crioglobulinas (positiva/negativa) permite incluir o excluir a un paciente en el diagnóstico de síndrome crioglobulinémico. Por otro lado, la principal utilidad de clasificar las crioglobulinas (tipo de inmunoglobulina y monoclonalidad) es que permite diferenciar una crioglobulinemia debida a un desorden maligno de las que se deben a estimulación del sistema inmune29. Además, la cuantificación de crioglobulinas es de utilidad en la toma de decisiones terapéuticas, así como en la monitorización del tratamiento de elección30. En las crioglobulinemias de tipo i, que se asocian a desórdenes linfoproliferativos, el tipo de crioglobulina tiene mayor relevancia en la patogénesis de la enfermedad subyacente que la carga de crioglobulinas17,19.
La caracterización de crioglobulinas se realiza en muestras de suero y el procedimiento de laboratorio se puede dividir en 3 fases:
- 1.
Fase preanalítica.
- 2.
Fase de detección.
- 3.
Fase analítica.
En esta fase es fundamental impedir que la temperatura caiga por debajo de 37°C durante periodos prolongados, con el fin de evitar la crioprecipitación4.
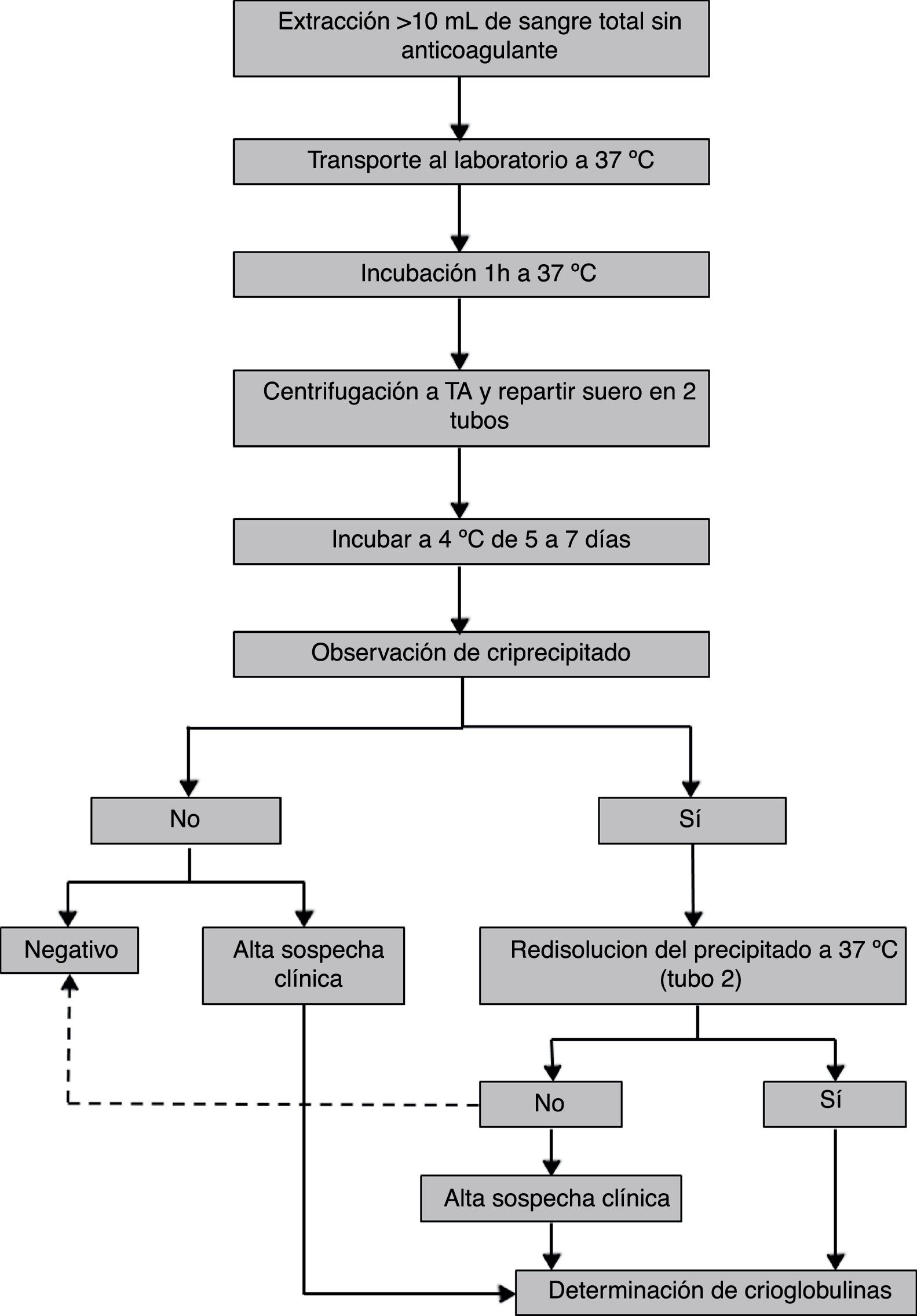
Se recomienda la extracción de al menos 10mL de sangre venosa sin anticoagulante (ya sea en tubos con o sin gel), con el fin de evitar falsos positivos debidos al criofibrinógeno o a proteínas que precipitan en presencia de heparina27. El volumen de muestra no debe ser inferior a 10mL, ya que la presencia de trazas de crioglobulinas es clínicamente relevante18,25 y en un volumen pequeño estas trazas pueden no ser detectadas. Para dicha extracción hay protocolos que recomiendan atemperar todo el material (agujas, jeringas y tubos)6,25,27,31.
Una vez obtenida la muestra de sangre, esta debe transportarse al laboratorio en termos de agua o arena o en otro contenedor32,33 que garantice que la temperatura permanezca en torno a los 37°C34. Posteriormente, una vez en el laboratorio y antes de la separación del suero, la muestra ha de incubarse al menos una hora a 37°C con el fin de que se disuelvan las crioglobulinas que hayan podido precipitar31,35,36.
Pasada la hora de incubación se separa el suero por centrifugación. Varios protocolos recomiendan que la centrifugación se realice a 37°C31,32,36,37 o, en caso de que el laboratorio no disponga de centrifugadoras termorregulables, se centrifugue a temperatura ambiente35,38,39 o se deje la muestra a 37°C y se recoja el sobrenadante sin haber centrifugado31. Una vez separado el suero es recomendable añadir azida sódica a 0,1g/L40 para su conservación y se divide, según el procedimiento analítico a seguir: si la cuantificación se realiza en base al criocrito se recogerá la mayor parte del suero en un tubo de sedimentación o tubo de hematocrito y se alicuotará un tubo adicional (tubo 2); si el método cuantitativo de elección es la concentración de proteínas totales o de inmunoglobulinas, se realizarán 2 alícuotas (tubo 1 y tubo 2). Todos los tubos se incubarán a 4°C entre 5 y 7 días.
Fase de detecciónEn esta fase, la práctica más habitual es realizar un cribado visual para descartar aquellas muestras en las que no se forma un precipitado visible tras la incubación a 4°C25,27,31,32. Este precipitado presenta por lo general un aspecto blanquecino, pero excepcionalmente es de aspecto gelatinoso o transparente, lo cual dificulta su visualización y puede catalogarse la muestra como negativa. Es por ello por lo que el personal técnico encargado de realizar la caracterización de crioglobulinas debe estar formado. Finalizada dicha incubación, utilizar el tubo 2 de las muestras con precipitado visible para comprobar que el precipitado desaparece al incubar a 37°C. Es una práctica común catalogar de negativas las muestras en las que no desaparece el precipitado a esta temperatura. Sin embargo, hay crioglobulinas que tienen dificultad para disolverse, sobre todo aquellas que arrastran grandes cantidades de complemento y otras proteínas por lo que, para no clasificar una crioglobulina erróneamente como negativa, se debe incubar la muestra un tiempo mínimo de 1h a 37°C. En este punto, las muestras que se redisuelvan se someterán a la fase de tipificación (fig. 2).
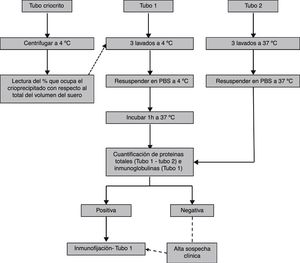
Fase analíticaEl protocolo de laboratorio recomendado para someter las muestras a la fase analítica se detalla en la tabla 2.
Protocolo de laboratorio recomendado para el procesamiento de muestras de crioglobulinas
| Tubo de criocrito: centrifugar 1.000 xg durante 10min a 4°C y realizar la lectura del porcentaje que ocupa el crioprecipitado con respecto al total del volumen del suero |
| Tubo 1 (5-7 días a 4°C) |
| Centrifugar a 2.000 xg 10min a 4°C |
| Separar el sobrenadante |
| Añadir 1,5mL de PBS frío al precipitado. |
| Agitar con vórtex durante unos 30 segundos o hasta que no haya precipitado visible. |
| Centrifugar y repetir el proceso de lavado 2 veces más. |
| Resuspender el crioprecipitado en PBS |
| Incubar las muestras durante 1h a 37°C antes de someterlas al método cuantitativo de elección |
| Tubo 2 (1h a 37°C): seguir mismo procedimiento que para el tubo 1 centrifugando a 37°C (o TA) y realizando los lavados con PBS a 37°C |
TA: temperatura ambiente.
Se aceptan 3 métodos de cuantificación: porcentaje que ocupa el crioprecipitado con respecto al volumen total del suero (criocrito), concentración de proteínas totales y concentración de inmunoglobulinas. Se ha propuesto también un «test rápido» de laboratorio, que consiste en medir por turbidimetría a 10°C y de manera continua hasta que ocurre la crioprecipitación. Este test se realizaría de forma complementaria a los test clásicos cuando el objetivo es la caracterización de crioglobulinas (pacientes para una primera determinación) o de forma exclusiva para el seguimiento de la enfermedad y el control de la eficacia de la plasmaféresis41.
De los métodos más extendidos, el criocrito, así como las proteínas totales, contienen la fracción inmunoglobulínica y otros factores relevantes que coprecipitan (como el complemento); sin embargo, también pueden contener proteínas contaminantes no deseadas, como la albúmina18. Estas contaminaciones pueden reducirse lavando el crioprecipitado. No obstante, en cada lavado puede perderse hasta un tercio del crioprecipitado, hecho relevante sobre todo en crioglobulinas que se encuentran a baja concentración. La determinación del criocrito es un método con buena sensibilidad, rápido y de bajo costo, pero requiere un gran volumen de muestra y tiene peor reproducibilidad que la cuantificación de proteínas totales. Además, no es útil para comparar índice de enfermedad entre pacientes y no está estandarizado en cuanto al volumen15. La cuantificación de proteínas totales es un método con mejor reproducibilidad y más exactitud que el criocrito, dada la automatización de la técnica y la cuantificación objetiva del resultado29,35. Además, permite minimizar la interferencia de proteínas que coprecipitan con las crioglobulinas si se calcula la diferencia entre la concentración del tubo a 4°C (tubo 1) y del tubo a 37°C (tubo 2), es decir, emplear el tubo 2 como blanco de la técnica.
En lo referente a los rangos de normalidad, no están estandarizados para la concentración total de proteínas, aunque algunos autores lo han establecido en 20-80mg/L29,35. Para los valores de inmunoglobulinas hay un solo estudio que los establece, resultando en que el 23% de 214 pacientes con crioglobulinemia superan este límite de normalidad42. Por tanto, debido a la actual carencia de estudios, es recomendable que cada laboratorio establezca el límite de normalidad testando una población de referencia de sujetos sin crioglobulinemia.
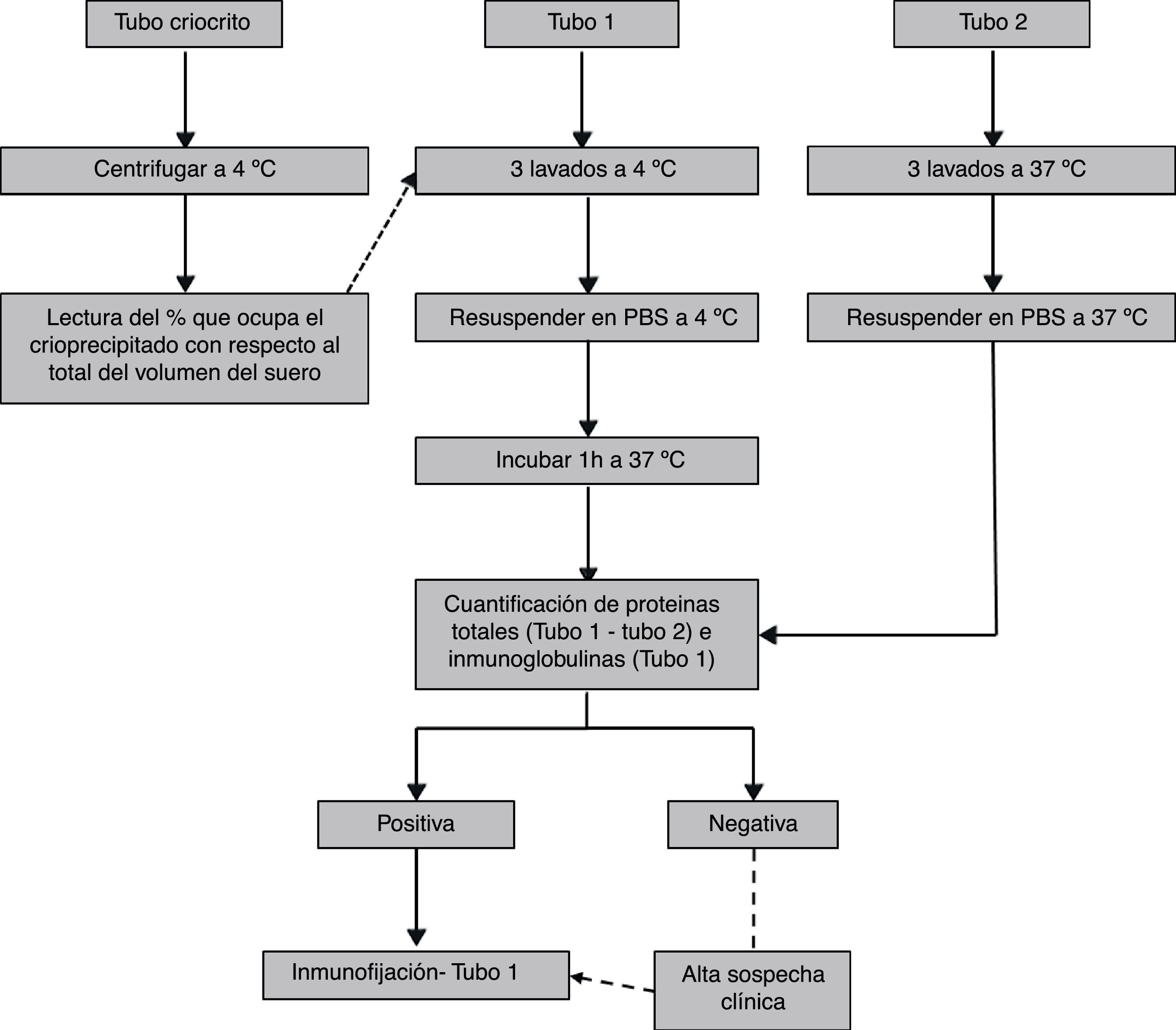
Tras el análisis cuantitativo, las muestras que resulten positivas (o negativas pero con alta sospecha clínica) deberán caracterizarse para completar el estudio. Las crioglobulinas pueden caracterizarse por métodos electroforéticos (ya sea en gel o capilar) o no electroforéticos (inmunoblot35, nefelometría de láser43, inmunodifusión37,44 o métodos de dispersión de luz45). Ya que el objeto de esta revisión es recomendar un protocolo para la estandarización inter-laboratorio, creemos que el método más sensible46,47, que aporta tanto la clase de crioglobulina como la clonalidad (información clínicamente relevante) y disponible en la mayoría de los laboratorios es la inmunofijación. Esta debe realizarse del crioprecipitado lavado a 4°C y resuspendido a 37°C. El procedimiento de laboratorio recomendado se indica en la figura 3.
Pruebas complementariasDentro de los criterios diagnósticos de síndromes crioglobulinémicos se incluyen la determinación del FR y el C4. Además, es de utilidad determinar los reactantes de fase aguda y completar el estudio del complemento (C1q, C2, C3, y CH50) en la primera determinación48, así como cuantificar las inmunoglobulinas tanto en la primera determinación como en determinaciones posteriores49. Otra aproximación para completar el estudio de crioglobulinas es la cuantificación de inmunoglobulinas en el sobrenadante que queda tras dejar precipitar 5-7 días a 4°C35. El FR y los reactantes de fase aguda están normalmente elevados. Los factores del complemento de la vía clásica (principalmente el C4)25 se encuentran disminuidos en las crioglobulinemias mixtas, aunque también pueden estarlo en las simples19. Sin embargo, el C3 se encuentra dentro de los rangos de normalidad o incluso ligeramente elevado debido a un mecanismo regulador ejercido por C4bp y factor i sobre la C3 convertasa de la vía clásica en estos pacientes50. Estas alteraciones serológicas de manera independiente han llevado al diagnóstico erróneo de vasculitis reumatoidea al no considerarse la presencia de crioglobulinas29, por lo que no deberían emplearse de manera aislada a la detección de crioglobulinas, sino de forma complementaria.
En pacientes positivos para crioglobulinas de tipo i y carentes de diagnóstico de base sería recomendable realizar un proteinograma del suero para descartar desórdenes hematológicos19. En los pacientes con crioglobulinemia mixta es preciso estudiar los marcadores de infección para el VHC, dada la alta asociación, en caso de que el paciente no esté ya diagnosticado de dicha hepatitis viral51,52. También es recomendable realizar un estudio de los marcadores de infección para otros virus (VHB, VIH)3,11, así como un cribado autoinmune10,12,21,53.
Conclusiones y discusiónLa detección de crioglobulinas es imprescindible para el diagnóstico de síndromes crioglobulinémicos. La naturaleza de las crioglobulinas y el propio mecanismo de crioprecipitación hacen que el procedimiento analítico sea muy largo (aproximadamente 7 días) y difícil de automatizar e incluso estandarizar. No obstante, es importante homogeneizar en lo posible el protocolo de caracterización de crioglobulinas entre los diferentes laboratorios. En un estudio realizado en 200854 se constató la gran variabilidad en la determinación de crioglobulinas. De los 140 laboratorios participantes en la encuesta solo un 36% empleaba algún método que garantizara que la temperatura no cayera de los 37°C hasta la separación del suero. En cuanto a la fase de crioprecipitación, el tiempo resultó ser muy variable, de 12h a 9 días, con un 30% de los laboratorios que dejaba menos de 3 días de precipitación a 4°C antes de la fase de detección. Tras la crioprecipitación, el 21% de los laboratorios no resolubilizaba el crioprecipitado a 37°C. En lo referente al análisis, solo el 42% empleaba algún método cuantitativo, y el 37% no caracterizaba el tipo de crioglobulina, informando únicamente la concentración de crioprecipitado como criocrito, concentración proteica total y/o concentración de inmunoglobulinas. Solo 3 laboratorios (2%) proporcionaban unos valores de referencia específicos para la cantidad total de proteínas del crioprecipitado y ninguno para la concentración de inmunoglobulinas.
La fase más crítica para la detección de crioglobulinas es la preanalítica. Para la recogida de muestra es recomendable, aunque no imprescindible, el precalentamiento del material de extracción1,17,36,39,55,56 dado que ni el tiempo ni la caída de temperatura durante los segundos que dura la extracción son suficientes para permitir que las crioglobulinas precipiten. Al igual que la mayoría de los protocolos publicados hasta la fecha consideramos que es crucial el transporte de la muestra al laboratorio a 37°C, así como la incubación 1h a 37°C para evitar falsos negativos por precipitación de crioglobulinas previa separación del suero. Para dicha separación centrifugar a 37°C, pero en caso de que el laboratorio no disponga de esta opción, es preferible centrifugar a temperatura ambiente57 a dejar sedimentar, puesto que al centrifugar se obtiene un suero con menos trazas de hematíes y fibrina, elementos que interfieren en la posterior determinación de crioglobulinas, dando lugar a falsos positivos. El riesgo de obtener un falso positivo de este modo es mayor al de obtener un falso negativo por precipitación de crioglobulinas durante la centrifugación a temperatura ambiente, dado que a esta temperatura solo serán capaces de precipitar parcialmente algunas crioglobulinas de tipo i que se encuentren a muy alta concentración, pero seguirán quedando solubles en su mayor parte y detectables en su posterior análisis35,39.
Obtenido el suero, este debe dejarse a 4°C para que se produzca la crioprecipitación. El tiempo adecuado es variable según los autores, desde un mínimo de 21,44 o 3 días18,32,36,39 hasta 76,11,15–17,20,27,35,37,51,55,58. Una incubación de menos de 5 días puede conllevar hasta un 30% de falsos negativos debido a que las crioglobulinas de tipo iii son más lentas en precipitar35. Por tanto, las muestras se deben incubar a 4°C de 5 a 7 días. Finalizado el tiempo de incubación, lo más extendido es catalogar como negativas aquellas muestras sin precipitado visible. Lo más adecuado sería realizar el procedimiento completo a todas las muestras dado que en las crioglobulinas que se encuentran a más baja concentración pueden interferir lípidos (especialmente quilomicrones) y fibrinógeno y no ser observables a simple vista29. Además, por motivos procedimentales, algunas muestras se incuban menos de 5 días, tiempo que puede ser insuficiente para que precipiten y que conllevaría falsos negativos. En todas estas situaciones sería recomendable que, al menos en pacientes con alta sospecha diagnóstica, se realizara la determinación completa aunque no se observe precipitado6,42.
En el procesamiento de las muestras durante la fase analítica, proponemos que el crioprecipitado se someta a 3 lavados a 4°C, número de lavados óptimo para eliminar proteínas contaminantes y perder el mínimo de crioprecipitado42. En lo referente a los métodos para la caracterización del crioprecipitado, es aconsejable la combinación de un método cuantitativo seguido de uno cualitativo en las muestras positivas. Como método cuantitativo, muchos grupos recomiendan el criocrito6,14,16,17,36,44,55,58. Por su poca reproducibilidad y falta de fiabilidad al comparar entre pacientes, no es un buen método para emplear de forma exclusiva, siendo aconsejable combinarlo con otro método cuantitativo32, como la cuantificación de inmunoglobulinas con reactivos capaces de detectar bajas concentraciones53,57. La cuantificación de proteínas totales es una buena aproximación del crioprecipitado, al menos en las crioglobulinemias mixtas35,39,51, dado que no se ha relacionado la cantidad de anticuerpos con el nivel de crioprecipitado, y este está constituido también por proteínas y factores del complemento, sobre todo en las crioglobulinemias asociadas a infecciones virales, en las que se encuentran antígenos víricos25. Estas proteínas al crioprecipitar podrían ser causa directa del daño, dado que se encuentran en los tejidos lesionados de pacientes con crioglobulinemia59,60. Al poder cuantificar de forma paralela una muestra a 37°C y eliminar de este modo las interferencias debidas a proteínas que coprecipitan de forma inespecífica, no es necesario combinar la cuantificación de proteínas con otro método cuantitativo. Por último, como método cualitativo para la caracterización del crioprecipitado secundamos la mayoría de las recomendaciones de la bibliografía al proponer la inmunofijación del suero6,11,14,16–18,32,36,55,58.
El objeto de esta revisión es, por tanto, la recomendación de un protocolo que elimine, o al menos disminuya, la gran variabilidad entre laboratorios tanto en la metodología de determinación como en el tipo de resultado informado.
Conflicto de interesesLos autores declaran no tener conflictos de intereses en la elaboración del presente manuscrito.
A todos los miembros del Grupo de inmunoquímica de la Sociedad Española de Inmunología por su colaboración en la revisión del presente documento.