Introducción
La artritis reumatoide (AR) es una enfermedad de causa desconocida y patogenia autoinmune que produce una inflamación de la membrana sinovial (sinovitis), característicamente erosiva y que ocasionalmente se acompaña de manifestaciones extraarticulares. En España la prevalencia de la AR es del 0,5%, lo que supone que hay en nuestro entorno alrededor de 200.000 personas afectadas 1. La enfermedad altera directamente la función física y la movilidad y ocasiona una marcada incapacidad funcional a corto y a largo plazo. Adicionalmente, las personas con artritis reumatoide tienen una expectativa de vida más corta que la población general 2 como consecuencia de un incremento en la mortalidad por enfermedad cardiovascular, infección y cáncer 3.
En ausencia de tratamiento curativo de la AR el objetivo terapéutico es obtener el mejor control posible de su actividad. Esto implica conseguir una disminución de la actividad inflamatoria suficiente para que disminuya significativamente el dolor, se prevenga o controle el daño articular y se preserve la capacidad funcional para realizar actividades cotidianas. Para ello, si bien no hay evidencia del impacto de estas actividades en el curso de la enfermedad, son importantes aspectos tales como la educación, la adaptación al entorno y la información precisa ante cada cambio relevante del tratamiento 4. En cuanto a la terapia farmacológica para mejorar los síntomas se recurre a los antiinflamatorios no esteroideos y a los corticosteroides a dosis bajas, tanto por vía oral como en infiltraciones intraarticulares. Los analgésicos se utilizarán a demanda como complemento a estas medidas. Adicionalmente, la práctica totalidad de los pacientes diagnosticados de AR precisarán del uso de los fármacos llamados modificadores de la enfermedad (FAME). La interconsulta con médicos rehabilitadores y la consideración de tratamiento quirúrgico en algunos casos son elementos importantes y a veces fundamentales en el tratamiento de los pacientes con AR.
En los últimos años ha habido una serie de cambios relevantes en el abordaje práctico del paciente con AR. El diagnóstico y el tratamiento precoz, la correcta evaluación inicial con la identificación de subgrupos de mal pronóstico, la definición de herramientas para la evaluación de la respuesta terapéutica, el tratamiento desde el inicio de la enfermedad con FAME, la aparición de nuevos fármacos y agentes biológicos y la generalización en la implantación de medidas de prevención de los efectos secundarios de las terapias utilizadas han supuesto una auténtica revolución en el tratamiento de esta enfermedad.
En nuestro medio la Sociedad Española de Reumatología ha desarrollado en los últimos años múltiples proyectos sobre facetas relevantes de la práctica médica en pacientes con AR que han sido objeto de amplia difusión. Entre éstos hay que incluir estudios epidemiológicos (EPISER), de comorbilidad (EMECAR), estudios acerca de variabilidad en el tratamiento de los pacientes (EMAR), una guía de práctica clínica en artritis reumatoide (GUIPCAR) 5, una base de datos de seguridad del uso de agentes biológicos (BIOBADASER) y consensos de uso de diversos fármacos. Revisaremos de forma secuencial los aspectos más relevantes del tratamiento de la AR.
Diagnóstico y tratamiento precoz
Los FAME modifican favorablemente el curso de la artritis reumatoide 6,7 controlando o aminorando el dolor, la inflamación y el deterioro radiológico a la vez que mejoran la capacidad funcional. Es por esto que se ha preconizado su utilización lo antes posible, casi como una urgencia 8,9, lo que conlleva la necesidad de diagnosticar a los pacientes a la mayor brevedad. Otro argumento a favor del diagnóstico y tratamiento precoz es que la evidencia de daño articular aparece sobre todo en los dos primeros años de la enfermedad y que una vez que se desarrollan las erosiones, rara vez revierten 10. Sin embargo, no siempre es fácil diagnosticar a pacientes con AR en las fases iniciales 11 por motivos tales como el retraso en el acceso a la atención especializada, que en algunos medios es de hasta 18 meses 12, la dificultad que plantea la diferenciación del proceso de otras causas de poliartritis y la limitación que los criterios de clasificación de AR de 1987 del Colegio Americano de Reumatología (ACR) tienen cuando se aplican para el diagnóstico en pacientes con artritis de corta duración 13.
Asimismo, es de gran interés identificar adecuadamente de entre los pacientes con artritis de reciente comienzo a los que van a desarrollar una artritis persistente y grave para seleccionar el FAME más adecuado. La gravedad de la AR se mide por la incapacidad funcional y por el deterioro anatomicorradiológico, que son eventos tardíos. Múltiples autores han evaluado y sugerido diversos marcadores como predictores de agresividad. Su presencia ayudará en la decisión de tratamiento 11,14,15 (tabla 1).
Para facilitar el acceso rápido a la atención especializada superando las frecuentes listas de espera, y además disponer de profesionales con experiencia en el diagnóstico ágil de pacientes con artritis se están desarrollando en la mayoría de los servicios/unidades de Reumatología, las denominadas «clínicas de artritis de reciente comienzo».
Evaluación inicial y seguimiento
Dado que algunos de los parámetros clínicos que permiten valorar la actividad inicial y la respuesta a los diversos tratamientos son subjetivos, el rigor en la valoración del enfermo es importante para realizar una práctica médica adecuada. En los últimos años se han desarrollado herramientas para el seguimiento de los pacientes, inicialmente definidas para ser utilizadas en los ensayos clínicos, pero que posteriormente han sido adoptadas en la práctica diaria con indudable utilidad (tabla 2) 16.
En la evaluación clínica inicial del paciente con artritis reumatoide hay que recoger, además de qué articulaciones están afectadas, la intensidad del dolor, la presencia de rigidez matutina, las posibles manifestaciones extraarticulares de la enfermedad, así como datos rutinarios en la anamnesis por órganos y aparatos que permitan identificar comorbilidad o patología concomitante. Es recomendable que el paciente complete un formulario de capacidad funcional validado, ya que va a ser de gran utilidad para el seguimiento. En España se suele utilizar el HAQ (Health Assessment Questionnaire) 17. En la exploración física se ha de hacer un reconocimiento general, y en la articular conviene anotar las articulaciones que están inflamadas y las que son dolorosas, así como las alteraciones articulares de índole mecánico (crepitación, limitación de movilidad, alteraciones del alineamiento, deformidad). Para facilitar esta práctica cada vez hay más formularios de desarrollo y uso local en los que además se incluyen escalas que reflejan la opinión del paciente y del médico sobre la actividad general de la enfermedad.
En la evaluación analítica, aparte de los datos útiles para el diagnóstico incluyendo el factor reumatoide y otros autoanticuerpos, conviene recoger la velocidad de sedimentación globular (VSG) o la proteína C reactiva (PCR) cuantificada para el seguimiento de la actividad. Son además de interés otros parámetros que permitan constatar disfunciones orgánicas y sirvan para el control de una posible toxicidad farmacológica (recuento hemático, creatinina, enzimas hepáticos, niveles de electrolitos, análisis de orina). El ACR recomienda una valoración de sangre oculta en heces siempre al comienzo y cuando en el seguimiento se estime conveniente. Algunos autores consideran oportuna la determinación en este momento de serologías para virus de la hepatitis B (VHB) y virus de la hepatitis C (VHC), así como la evaluación de una posible tuberculosis latente. El estudio del líquido sinovial será de interés en la evaluación inicial y posteriormente en caso de aparición o persistencia de monoartritis en el contexto de aparente control de la inflamación en el resto de las articulaciones («articulación fuera de fase»), para descartar infección.
La valoración radiológica inicial ha de incluir, además de la que se estime oportuna en cada caso, radiografías de manos y de antepiés que servirán para establecer el nivel basal de afectación articular (pinzamiento y erosiones) y monitorizar la progresión radiológica de la enfermedad y la respuesta al tratamiento. La resonancia magnética y los estudios ecográficos no se usan rutinariamente en la evaluación precoz de las erosiones en pacientes con AR a pesar de su demostrada utilidad 18.
En el seguimiento de los enfermos con AR el médico determinará en cada revisión si la enfermedad está activa o inactiva, y en el primer caso tratará de saber cuál es el grado de actividad con el fin de hacer las modificaciones pertinentes del tratamiento. En los últimos años se han desarrollado índices compuestos que integran la información en valores concretos; para la evaluación de respuesta se han impuesto en los ensayos clínicos los criterios del ACR y para la práctica diaria está ganando terreno el denominado DAS28 (incluye el número de articulaciones dolorosas e inflamadas, la VSG y la evaluación global del paciente) 5. En este sentido se ha planteado que en la AR el objetivo terapéutico sería conseguir un bajo grado de actividad definido como un valor de DAS28 < 3,2 19 o en su defecto menos de 5 articulaciones tumefactas y dolorosas.
Tratamiento farmacológico de la artritis reumatoide
Antiinflamatorios no esteroideos
La utilización de antiinflamatorios no esteroideos (AINE) solos o asociados a los corticosteroides se recomienda en la fase inicial de la artritis, cuando se introduce un nuevo FAME mientras éste alcanza su nivel de eficacia (generalmente de dos a 12 semanas) o cuando persisten síntomas a pesar del tratamiento concomitante con los FAME sin que haya indicación de cambio del mismo 5.
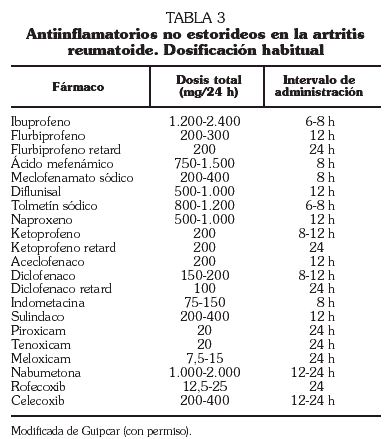
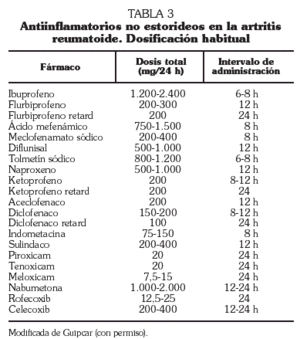
La elección de AINE entre los disponibles se ha de basar en consideraciones de eficacia, seguridad y coste (tabla 3). Es, asimismo, importante tener en cuenta que hay una gran variación individual en la respuesta a los AINE, por lo que es buena práctica cambiar un AINE por otro tras un par de semanas si no hay mejoría suficiente. Los AINE actúan sobre la producción de prostaglandinas inhibiendo una o las dos isoformas del enzima ciclooxigenasa (COX-1 y COX-2). Es sabido que la COX-1 se produce constitutivamente y está presente en muchas células, incluidas las plaquetas, células de la pared gástrica y de la mucosa intestinal y en las células endoteliales. La producción de COX-2, por el contrario, puede incrementarse en los sitios en los que hay inflamación. Hay datos que demuestran que los fármacos que inhiben de forma selectiva la COX-2 (coxib) son tan efectivos como los AINE convencionales, y además tienen un riesgo menor de efectos adversos gastrointestinales. Sin embargo, su coste es más elevado, lo que ha llevado a plantear análisis de coste-efectividad y a medidas encaminadas a racionalizar su utilización. Recientemente se han publicado las recomendaciones conjuntas de la Sociedad Española de Reumatología y la Asociación Española de Gastroenterología para la prevención de los efectos adversos sobre el tracto digestivo de los AINE 20.
En el momento de prescribir un AINE a un paciente con AR hay que considerar, además de la eficacia, aspectos tales como el riesgo para el desarrollo de úlceras tanto gastroduodenales como en el tracto digestivo bajo, y evaluar condiciones patológicas que determinen un volumen intravascular disminuido o edema.
Son factores de riesgo para el desarrollo de úlceras gastroduodenales la edad por encima de 60 años (y sobre todo a partir de los 75), la historia de úlceras digestivas, el uso concomitante de corticosteroides o de anticoagulantes, la utilización de dosis elevadas de AINE o el hecho de padecer una enfermedad grave subyacente 21,22. En estos casos, nada infrecuentes en pacientes con AR las posibilidades prácticas son prescribir dosis bajas de prednisona en lugar de AINE, el uso de un coxib o utilizar una combinación de un AINE clásico con gastroprotección (un inhibidor de bomba de protones [IBP] o misoprostol). Esta última posibilidad no sería de utilidad en la prevención de úlceras en el tracto digestivo bajo.
Cuando hay antecedente de complicaciones digestivas graves (hemorragia digestiva o perforación) lo prioritario es evitar los AINE recurriendo a dosis bajas de prednisona, ya que tanto los coxib como los AINE no selectivos con omeprazo tienen un riesgo relativamente elevado de reaparición de las complicaciones 23. No obstante, si hubiera que utilizarlos sin evidencia disponible en la actualidad parece razonable usar un coxib con gastroprotección adecuada.
El uso hoy tan frecuente de ácido acetilsalicílico (AAS) a dosis bajas para profilaxis de eventos cardiovasculares añade una cierta complejidad, ya que el riesgo de hemorragia digestiva aumenta con la asociación de AAS con un AINE. Además, ni los AINE no selectivos ni desde luego los coxib pueden suplir el efecto del AAS a nivel cardiovascular, y su asociación tanto con unos como con otros deja en duda los efectos secundarios a nivel digestivo. Según el referido consenso, en un paciente antiagregado podría utilizarse un coxib por su mejor perfil de seguridad a lo largo de todo el tracto gastrointestinal. La erradicación de Helicobacter pylori en estas circunstancias contribuye a reducir el riesgo de hemorragia.
Adicionalmente, hay que evitar el uso de AINE en condiciones asociadas con edema o volumen intravascular disminuido, tales como insuficiencia cardíaca congestiva, síndrome nefrótico o cirrosis y en pacientes con insuficiencia renal (creatinina por encima de 2,5 mg/dl). En estos casos el manejo de la inflamación articular con dosis bajas de prednisona parece adecuado.
Corticosteroides
Los corticosteroides a dosis bajas (menos de 10 mg/día de prednisona o equivalente) producen un marcado alivio sintomático en pacientes con AR. Hay evidencia que sugiere que la dosis baja de esteroides retarda la progresión del daño articular, por lo que podrían tener una cierta acción de modificación de la enfermedad 24. Recientemente se ha comunicado que una dosis de 7,5 mg de prednisolona diaria añadida desde el principio a los FAME condiciona un mejor pronóstico a los dos años 25. Sin embargo, los corticosteroides no deben reemplazar a los FAME. Además, incluso las dosis bajas no están exentas de efectos secundarios a largo plazo tales como osteoporosis, cataratas, retención hidrosalina, hiperglucemia, hipertensión y fragilidad capilar.
Los corticosteroides se han de usar en la AR:
1) Cuando los AINE están contraindicados o tienen un riesgo elevado de efectos adversos (ancianos, morbilidad elevada asociada).
2) Como tratamiento puente hasta el inicio de la acción de los FAME.
3) Cuando los AINE no son suficientes para el control de la inflamación (generalmente añadiendo los corticosteroides a los AINE).
4) En el tratamiento de la forma pseudopolimiálgica de AR senil. Serán asimismo indicación de tratamiento esteroideo las complicaciones sistémicas de la AR que lo precisen 5.
Las infiltraciones intraarticulares y periarticulares son seguras y eficaces cuando se administran adecuadamente. Están indicadas cuando alguna articulación aislada se inflama, antes de recurrir a modificaciones del tratamiento general del proceso y después de descartar otras causas, particularmente la infección. Recientemente se ha evaluado el papel de infiltraciones intraarticulares múltiples como tratamiento coadyuvante para facilitar el control de la enfermedad en las fases iniciales 26. Asimismo, las infiltraciones intra o periarticulares son útiles para facilitar el inicio de programas de rehabilitación. En los casos de inflamación articular persistente tras infiltraciones intraarticulares repetidas, en los que no haya un deterioro del cartílago ni de la alineación articular, sigue siendo de utilidad la sinoviolisis radioisotópica.
Los pacientes con AR tienen un riesgo incrementado de osteoporosis, y como se ha señalado, dosis incluso tan bajas como 5-7,5 mg de prednisona pueden contribuir a la pérdida de masa ósea. Por este motivo se recomienda facilitar un suplemento adecuado de calcio (1.500 mg de calcio elemental incluido el de la dieta) y de vitamina D (400-800 UI) al día. Los bifosfonatos previenen la pérdida de masa ósea y deberían utilizarse desde el comienzo si se prevé un tratamiento esteroideo prolongado 27, sobre todo en personas en las que se ha evidenciado una masa ósea baja.
Fármacos modificadores de enfermedad
En general, todos los pacientes con AR deben ser tratados con un FAME en cuanto se establezca el diagnóstico. Los FAME tienen el potencial de reducir o prevenir el daño articular, preservar la integridad y la función, reducir el coste en recursos sanitarios y adicionalmente mantener la actividad laboral de los pacientes con AR. El tratamiento con FAME no debería retrasarse más de tres meses desde el inicio de los síntomas en todo paciente con artritis en el que, a pesar de un tratamiento adecuado con AINE, persista dolor, rigidez matutina, cansancio, sinovitis activa, aumento de VSG o PCR, o aparezcan erosiones. Asimismo, este tratamiento ha de mantenerse en el tiempo para que su eficacia perdure 28. Los FAME que se utilizan actualmente en el tratamiento de la AR se recogen en la tabla 4.
Cloroquina/hidroxicloroquina/sulfasalazina
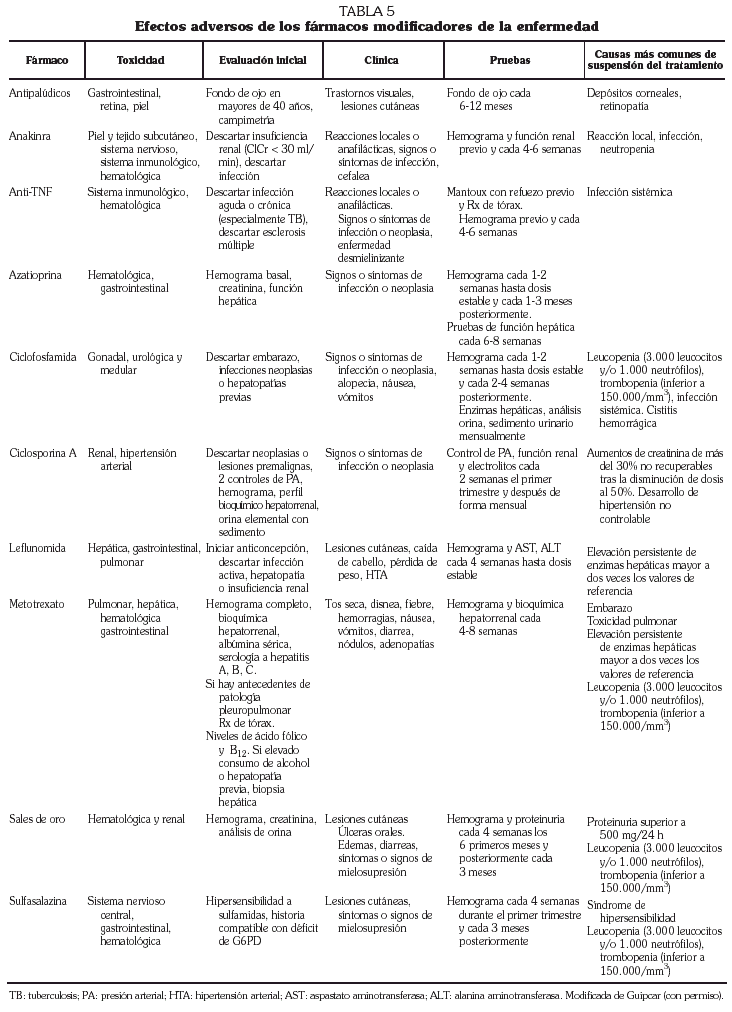
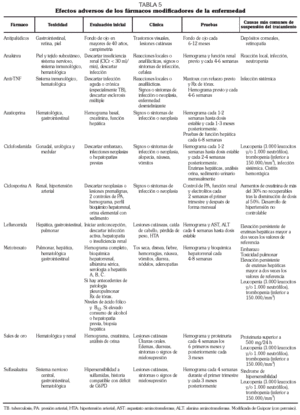
Los antipalúdicos de síntesis producen alivio sintomático, sobre todo en pacientes con enfermedad inicial con pocos datos predictores de agresividad. Aunque dados en monoterapia no producen enlentecimiento de la progresión de las lesiones radiológicas, sí tienen impacto en la evolución sintomática a largo plazo. Además, se utilizan con cierta frecuencia asociados a metotrexato. El período de inicio en la mejoría inducida por antipalúdicos oscila entre uno y 6 meses. Entre sus efectos adversos los más frecuentes son rash cutáneo, dolores abdominales y diarrea, y aunque infrecuente, sobre todo a dosis mayores de 6 mg/kg de hidroxicloroquina (HCQ) o 3,75 mg/kg de cloroquina (CQ), la más grave toxicidad retiniana (tabla 5). Habitualmente el tratamiento con antipalúdicos no precisa controles analíticos periódicos; sin embargo, se aconseja evaluación oftalmológica previa (en particular en mayores de 40 años) y cada 6-12 meses.
La sulfasalazina (SSA) actúa de forma relativamente rápida (menos de 4 meses) y retrasa la progresión radiográfica de la AR. Las reacciones adversas más frecuentes se producen sobre el sistema nervioso central (cefalea, vértigo) y sobre el gastrointestinal (anorexia, náusea, vómitos, dolor abdominal). En general son leves y no requieren suspensión del tratamiento. Otros efectos adversos menos frecuentes son hematológicos, como macrocitosis, leucopenia, neutropenia y anemia megaloblástica. Se han comunicado apariciones aisladas de anemia aplásica, agranulocitosis, trombopenia y leucocitosis. La toxicidad hematológica puede presentarse en cualquier momento del tratamiento, aunque suele aparecer precozmente (entre la quinta y la duodécima semana). Se recomienda hemograma cada mes los tres primeros meses y posteriormente cada tres meses.
Metotrexato
El metotrexato (MTX) es el fármaco recomendado en todos aquellos pacientes que no han recibido previamente ningún FAME. Es efectivo en la producción de mejoría sintomática, especialmente en los pacientes con AR más activa 29,30. Asimismo se ha demostrado que su uso mejora la calidad de vida de los enfermos con AR 31, retrasa la progresión radiológica 32 y disminuye la mortalidad 33. Es el fármaco con mejor perfil de eficacia/tolerancia, por lo que en los análisis de tiempo de uso mantenido es el que más perdura 34,35. El MTX es el fármaco más utilizado en España, tanto en monoterapia como asociado a otros FAME 36. Se usa a las dosis señaladas en la tabla 4, predominantemente por vía oral.
Los efectos secundarios más relevantes del MTX son toxicidad hepática, pulmonar y hematológica. Otros efectos son infecciones, aumento de los nódulos subcutáneos, toxicidad gastrointestinal, toxicidad neurológica y carcinogénesis. La estomatitis, la náusea, la hiperhomocisteinemia 37 y probablemente la alopecia ocasionada por el metotrexato disminuyen con la coadministración de ácido fólico o folínico 38. En caso de intolerancia digestiva se puede intentar la administración subcutánea o intramuscular a las mismas dosis.
Para el seguimiento de pacientes con AR tratados con MTX en la GUIPCAR se recomienda evaluación previa a la instauración del tratamiento con hemograma completo, bioquímica hepatorrenal y albúmina sérica, así como serología a virus de la hepatitis A (VHA), VHB y VHC. En casos excepcionales (hepatopatía previa o exposición a hepatotóxicos) se recomienda biopsia hepática pretratamiento. Se recomienda, asimismo, hemograma y bioquímica hepatorrenal cada 4-8 semanas, lo que está en consonancia con el ACR 39. Recientemente se han planteado dudas acerca de que una vez transcurrido un período inicial de seguimiento más estrecho sean precisos controles tan frecuentes 40,41. Sin embargo, antes de cambiar las pautas de monitorización es preciso un período de reflexión y análisis.
Se consideran contraindicaciones absolutas para uso del metotrexato el embarazo, el alcoholismo, el VHB o VHC y cirrosis de cualquier origen. Son contraindicaciones relativas la insuficiencia renal la enfermedad pulmonar crónica y la infección activa no asociada a síndrome de Felty.
Sales de oro
Las sales de oro son el tratamiento de fondo clásico de la AR. Están disponibles en España por vía oral (auranofín) y parenteral (aurotiomalato sódico). El auranofín tiene un escaso impacto en la progresión radiológica en comparación con otros FAME 42, por lo que prácticamente no se utiliza. El aurotiomalato sódico es efectivo en la mejoría de los síntomas, en la ralentización de la progresión radiográfica 43 y en la mejoría de la calidad de vida de los pacientes con AR. Es manifiesta la eficacia de las sales de oro cuando se asocian a metotrexato 44. Sin embargo, su relevante toxicidad condiciona una tasa elevada de suspensión a medio plazo 45,46, lo que junto a la aparición de otros agentes ha llevado a una marcada reducción en su utilización 47. Recientemente se ha evidenciado el desarrollo de erosiones en AR de inicio tratada en primera opción con sales de oro y en segunda con MTX, a pesar de un aparente aceptable control clínico, lo que supone una llamada de atención 48.
Los efectos secundarios clínicamente más relevantes de las sales de oro son la toxicidad hematológica y la renal. Son más frecuentes en el tratamiento parenteral y requieren un estrecho seguimiento clínico y la suspensión del tratamiento para evitar secuelas irreversibles. Los efectos hematológicos más frecuentes son eosinofilia y trombopenia, seguidos de neutropenia. Se han comunicado, además, anemia aplásica y aplasia selectiva de la serie roja. La toxicidad renal más frecuente es la glomerulonefritis membranosa. Otros efectos adversos son toxicidad cutánea (dermatitis, prurito), hepática (ictericia con o sin colestasis intrahepática), pulmonar (neumonitis, bronquilitis obliterante), gastrointestinal (enterocolitis tóxica), neurológica y oftálmica.
La monitorización del tratamiento con sales de oro consiste en controles periódicos hematológicos y de proteinuria mediante análisis elemental de orina (cualitativo o semicuantitativo) cada 4 semanas los 6 primeros meses y posteriormente trimestral 5. Si hay proteinuria se ha de medir en orina de 24 horas. Si supera los 500 mg/24 h, el tratamiento ha de suspenderse hasta que desaparezca o sea inferior a 200 mg/ 24 h, pudiéndose reiniciar posteriormente. Si la proteinuria ha sido muy intensa (superior a 1 g/24 h) se suspenderán las sales de oro definitivamente.
Leflunomida
La leflunomida es una alternativa para el tratamiento de pacientes con AR que no toleran o no responden adecuadamente a MTX49 La dosis habitual es de 20 mg/día por vía oral de forma continua. Produce mejoría clínica y funcional y tiene un impacto favorable en la progresión de las lesiones radiológicas 50-52. En monoterapia tiene una eficacia similar a metotrexato y sulfasalazina con moderadas diferencias 53,54, si bien la tasa de permanencia en tratamiento con el fármaco es ligeramente menor que la del MTX 55. Su efecto favorable se mantiene en evaluaciones a largo plazo 56. La adición de leflunomida a metotrexato en casos de pacientes con respuesta insuficiente a éste demuestra un claro efecto beneficioso 57; sin embargo, la ficha técnica en España en la que se desaconseja dicha asociación supone un obstáculo formal.
Los efectos adversos más frecuentes en los ensayos clínicos publicados con leflunomida son los gastrointestinales (diarrea, náusea y dolor abdominal) y los del aparato respiratorio (infección de vías aéreas superiores y bronquitis). Estos efectos son en general leves, no son dosis dependientes y no obligan a la suspensión del tratamiento. Otros efectos menos frecuentes son hipertensión, cefalea, vértigo, pérdida de peso y alopecia. Se han descrito elevaciones de las transaminasas en aproximadamente el 6% de los pacientes, reversibles tras la suspensión. Se han notificado casos de daño hepático grave, algunos con desenlace de muerte, que en la mayoría de los casos ocurrieron durante los 6 primeros meses de tratamiento. La leflunomida es un potente teratógeno, por lo que en las mujeres tratadas que deseen quedarse embarazadas, ha de ser suspendida y debe realizarse un lavado con colestiramina antes de intentar la concepción.
En pacientes tratados con leflunomida se recomienda monitorizar los enzimas hepáticos inicialmente cada 4 semanas hasta alcanzar una dosis de tratamiento estable. Si se produce una elevación al doble del valor máximo de referencia se debe disminuir la dosis a 10 mg/día. Si no se consigue una reducción a 1,2 veces el valor máximo de referencia se debe suspender la leflunomida y administrar colestiramina. Asimismo se recomienda vigilar periódicamente la posible aparición de anemia y leucopenia.
Agentes biológicos
El interferón alfa (TNF-α) y la interleucina-1 (IL-1) participan activamente en múltiples procesos inflamatorios en general, y en particular en los que tienen lugar en artropatías inflamatorias como la AR. La consecuencia directa ha sido el desarrollo con fines terapéuticos de diversos agentes biológicos específicos contra el TNF-α y la IL-1. Entre los primeros se encuentran comercializados en España los anticuerpos monoclonales dirigidos contra el TNFα quiméricos (parte de ratón y parte humana) (infliximab) o humanos (adalimumab) y moléculas portadoras de fracciones solubles del receptor del TNFα, p75 (etanercept). Por su parte, el anakinra es una forma recombinante del antagonista del receptor de la interleucina-1 humana (IL-1 Ra) y neutraliza la actividad biológica de la IL-1 (IL-1α e IL-1β).
Los agentes anti-TNF usados tanto en monoterapia como en asociación a metotrexato han demostrado una marcada efectividad en el tratamiento de pacientes con AR de inicio 58 y en AR refractaria a los tratamientos habituales 59-61. Los agentes anti-TNF tienen un efecto favorable tanto en la actividad clínica como en la calidad de vida de los pacientes 62. Como se ha señalado previamente, un objetivo fundamental en el tratamiento de la artritis reumatoide es la detención de la destrucción articular. Los agentes anti-TNF han mostrado capacidad de enlentecimiento o incluso detención de la progresión de las lesiones radiológicas. Hallazgos similares, aunque en algunos parámetros de menor intensidad, han sido evidenciados con anakinra 63.
La eficacia de los diversos agentes anti-TNF es similar 64 y el coste parecido. Las principales diferencias entre ellos son las derivadas de la necesidad de coadministración de metotrexato (imprescindible con infliximab, potestativa con los demás), la vía de administración (intravenosa en el caso de infliximab, por lo que precisa ingreso hospitalario o acceso a un hospital de día y subcutánea en el de adalimumab y etanercept) y la frecuencia de administración (cada 6-8 semanas el infliximab, cada dos el adalimumab y dos veces por semana el etanercept).
Sin embargo, a pesar de que la mejoría obtenida con agentes biológicos es importante, sigue existiendo un elevado porcentaje de pacientes con AR (alrededor de un 30%) que no responden a los agentes biológicos, siendo excepcionales los que entran en remisión clínica. Una posibilidad en estos casos es pasar de uno a otro agente anti-TNF 65. Asimismo, hay que reseñar que la eficacia de estos agentes revierte a las pocas semanas de su suspensión. Una cuestión relevante se deriva del elevado coste de estos tratamientos, y aunque en los estudios coste-efectividad realizados gran parte de los costes se compensan con el ahorro directo e indirecto, para un uso racional es importante ajustarse a unos criterios consensuados. En este sentido, la Sociedad Española de Reumatología dispone de unas recomendaciones que renueva periódicamente acerca del uso de agentes biológicos en nuestro entorno.
En cuanto a los efectos adversos, tras varios años de experiencia en la utilización de agentes anti-TNF para el tratamiento de diversos procesos patológicos, los que en algún momento han planteado una especial preocupación han sido: infecciones, incluyendo tuberculosis y sepsis; tumores, como linfomas; otros trastornos hematológicos, como anemia y pancitopenia; enfermedades desmielinizantes/neuropatía, empeoramiento de insuficiencia cardíaca congestiva, aparición de autoanticuerpos/autoinmunidad y finalmente reacciones a la infusión/inyección y de hipersensibilidad.
Dado que el entorno sociosanitario local puede conferir peculiaridades relevantes en el uso de cualquier agente terapéutico, en España la División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española del Medicamento y Productos Sanitarios y la Sociedad Española de Reumatología pusieron en marcha en 2001 una base de datos para el registro de efectos adversos de los agentes biológicos en enfermedades reumáticas (BIOBADASER). En el informe de dicho registro de fecha de 26 de junio de 2003 se incluyen 2.866 pacientes precedentes de 86 centros. Dos mil quinientos treinta y cuatro pacientes han recibido infliximab y 436 etanercept (algunos enfermos han recibido ambos de forma secuencial) 66.
Se han comunicado un total de 712 acontecimientos adversos en 565 pacientes (en 108 pacientes se comunicaron dos acontecimientos, en 27 pacientes tres y en 12 pacientes 4 o más).
El tipo de acontecimiento adverso más frecuentemente comunicado fue la infección (n = 277; 38,9%), seguido de reacciones infusionales (n=196; 27,5%) y de trastornos cutáneos (n = 260; 36,5%). Se han encontrado problemas cardiovasculares en 32 casos (4,49%), citopenias en 21 casos (2,95%) y neoplasias en 13 (1,83%).
En lo que respecta a las infecciones, el germen comunicado con mayor frecuencia fue el Mycobacterium tuberculosis 67 (n = 29; 10% de todas las infecciones). La tasa de incidencia de tuberculosis en tratados con anti-TNF fue en 2001 de 1.010 por 100.000 personas, siendo la de la población general en ese año de 18,83/100.000 habitantes. Todos los pacientes registrados con tuberculosis habían estado en tratamiento con infliximab y en la mayoría de los casos los síntomas comenzaban al inicio del tratamiento, lo que hacía sospechar la reactivación de una TB latente. El 4 de febrero de 2002 la Agencia Española del Medicamento y Productos Sanitarios publicó una nota informativa con las advertencias sobre la aparición de infecciones graves y las precauciones que habían de tomarse antes del tratamiento con infliximab. Se recomienda realizar una historia detallada de exposición previa, infección o contactos, un Mantoux (con refuerzo en caso negativo) y una radiografía de toráx antes del tratamiento. Los pacientes con infección activa deben ser tratados antes del tratamiento con anti-TNF y aquellos con infección tuberculosa latente deben recibir profilaxis. Es importante señalar que en los pacientes que han iniciado tratamiento con infliximab siguiendo estas recomendaciones no se ha registrado en el Biobadaser ningún caso de tuberculosis.
En diversos registros, incluido el Biobadaser, se recogen además otras infecciones que afectan a las vías respiratorias, la piel, el sistema urinario y a las articulaciones, entre otras, e incluyen, aunque con escasa frecuencia, casos de neumonías graves, meningitis y sepsis, así como infecciones por listeria, Pneumocistis carinii, Coccidiomycosis y Candidiasis 68.
Tratamientos combinados
Los tratamientos convencionales son a menudo inadecuados para obtener un control de los síntomas o prevenir la progresión de la AR. Por este motivo se han evaluado múltiples combinaciones de FAME en estudios a menudo con poder estadístico insuficiente. Además de las señaladas asociaciones de agentes biológicos con metotrexato y leflunomida con metotrexato, las asociaciones mejor evaluadas han sido la de ciclosporina más metotrexato y la denominada triple combinación (metotrexato, hidroxicloroquina y sulfasalazina). En el primer caso la ciclosporina añadida al metotrexato ha demostrado ser más efectiva que el metotrexato solo, aunque el seguimiento a largo plazo ha evidenciado en los pacientes más hipertensión y elevación de niveles de creatinina 69,70. En el segundo la triple combinación es significativamente más eficaz que el metotrexato en monoterapia o que la combinación hidroxicloroquina y sulfasalazina 71, metotrexato más sulfasalazina o metotrexato más hidroxicloroquina 72, tanto en AR inicial 73 como evolucionada 74. Para muchos reumatólogos la triple combinación es el tratamiento de elección en AR inicial con signos de mal pronóstico.
Selección de fármacos modificadores de enfermedad
La elección de un FAME depende de muchos factores. En la guía de práctica clínica de la Sociedad Española de Reumatología (SER) se han considerado como los más importantes la presencia o ausencia de erosiones y el número de articulaciones tumefactas (mayor o menor de 6). Aunque hay múltiples aproximaciones al tema, desde un punto de vista práctico se puede considerar:
1) El tratamiento inicial de elección en cualquier caso de artritis reumatoide diagnosticada es el metotrexato.
2) En casos de artritis con ausencia de erosiones y con un número de articulaciones inflamadas menor de 6, como alternativas se podrían considerar la sulfasalazina y los antipalúdicos.
3) Si el número de articulaciones inflamadas es elevado o hay erosiones es exigible el uso de metotrexato, llegando a las dosis máximas recomendadas salvo intolerancia (tabla 4). Como alternativa se podría plantear la triple terapia (metotrexato + antipalúdico + sulfasalazina), y en caso de ineficacia la leflunomida.
4) Si hay intolerancia al metotrexato en los pacientes del apartado anterior se pueden considerar además de la leflunomida, la sulfasalazina y las sales de oro por vía parenteral.
5) De acuerdo con las recomendaciones del consenso de la SER para el uso de agentes anti-TNF, éstos estarán indicados en pacientes con AR cuando no se haya conseguido el objetivo terapéutico (DAS28 < 3,2 o menos de 5 articulaciones inflamadas y dolorosas) tras utilizar al menos dos de los tres FAME considerados más relevantes (metotrexato, leflunomida, sulfasalazina) a las dosis y con una duración adecuada, ya sea en monoterapia o en terapia combinada y siempre que uno de ellos haya sido el metotrexato 75.
Una vez iniciado tratamiento con uno de los agentes anti-TNF disponibles se evaluará la respuesta a las 16 semanas. Si con el agente utilizado se obtiene el objetivo terapéutico se continuará el tratamiento de forma indefinida realizando cada 3-4 meses evaluaciones clínicas y analíticas. Si pasadas 16 semanas no se consigue dicho objetivo puede pasarse de un anti-TNF a otro. El anakinra podría ser una alternativa si hay intolerancia manifiesta a los agentes anti-TNF.
Aunque el camino por recorrer es largo es una evidencia que en el tratamiento de los enfermos con AR se ha abierto en los últimos años una puerta a la esperanza.