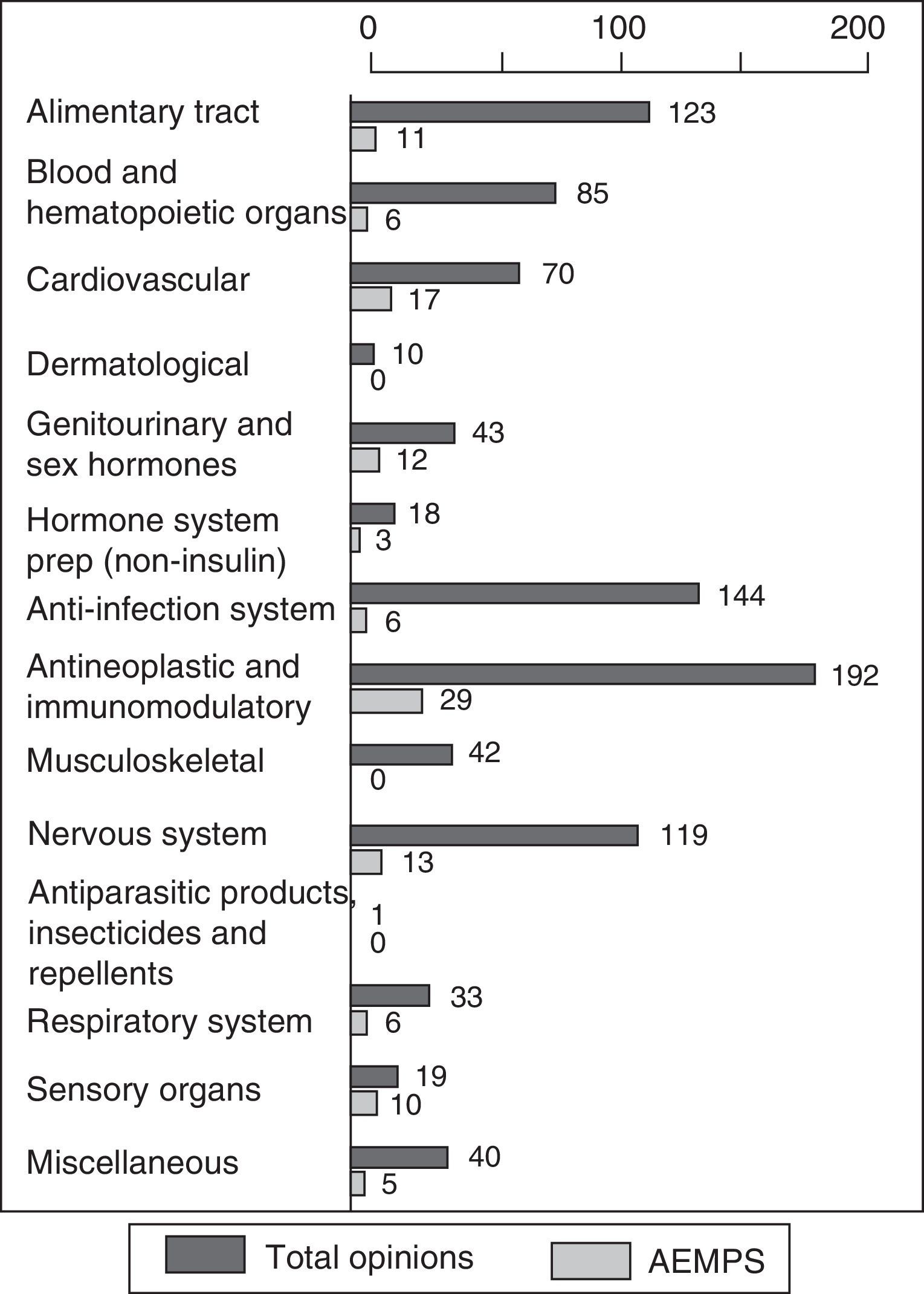
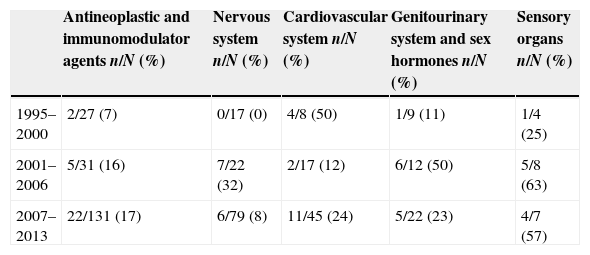
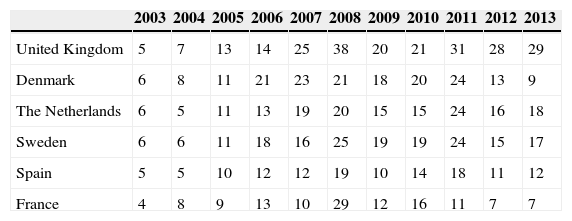
The centralized procedure for registering medicinal products involves a joint assessment by all regulatory agencies of European Union member states, which are coordinated by the European Medicines Agency. Since its implementation in 1995, the Spanish Agency for Medicines and Healthcare Products (AEMPS) has actively contributed to the committee on medicinal products for human use. The therapeutic areas in which AEMPS has the greatest presence are cardiovascular, sensory organs (mainly ophthalmology) and genitourinary/sexual hormones. The technical staff of AEMPS contribute their expertise and extensive experience to this task, as do the practitioners of the Spanish healthcare system who act as external experts, providing their clinical vision and bringing the daily clinical practice to the evaluation of medicinal products. As with other European decision spaces, the joint participation of the member states is not homogeneous, with a minority of countries still heading the majority of assessments for the committee on medicinal products for human use, although all member countries take part in the final decision.
El procedimiento de registro de medicamentos centralizado implica una evaluación conjunta por todas las Agencias Reguladoras de los Estados miembros de la Unión Europea que es coordinada por la Agencia Europea de Medicamentos. Desde su implantación en 1995, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha contribuido de forma activa al Comité de medicamentos de uso humano. Las áreas terapéuticas en las que la AEMPS tiene más presencia son cardiovascular, órganos de los sentidos (fundamentalmente oftalmología) y genitourinario-hormonas sexuales. A esta labor contribuyen con sus conocimientos y su extensa experiencia los técnicos de la propia AEMPS así como profesionales del sistema sanitario español que actúan en calidad de expertos externos aportando su visión clínica y acercando la práctica diaria a la evaluación de medicamentos. Como sucede con otros espacios de decisión europeos, la participación del conjunto de Estados miembro no es homogénea siendo todavía una minoría de países los que lideran la mayoría de las evaluaciones del Comité de medicamentos de uso humano, aunque todos los países toman parte en la opinión final.
Artículo
Diríjase desde aquí a la web de la >>>FESEMI<<< e inicie sesión mediante el formulario que se encuentra en la barra superior, pulsando sobre el candado.
Una vez autentificado, en la misma web de FESEMI, en el menú superior, elija la opción deseada.

>>>FESEMI<<<
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora