El gen SERPINA1 codifica la proteína alfa-1 antitripsina (AAT1). Los posibles desequilibrios entre las concentraciones de proteasas y antiproteasas (AAT1) puede hacer que se desarrollen patologías pulmonares y extrapulmonares graves. En este trabajo estudiamos la importancia de este posible disbalance en los pacientes con COVID-19.
ObjetivosCorrelacionar la gravedad de la clínica de la infección por SARS-CoV-2 con las concentraciones de AAT1 al diagnóstico de la enfermedad.
MétodosEstudio observacional, prospectivo, transversal, no intervencionista con carácter analítico, donde se seleccionaron 181 casos con COVID-19 ingresados en el Hospital Clínico Universitario «Lozano Blesa» de Zaragoza. A todos ellos se les estudió la concentración de AAT1 y se correlacionó con los aspectos clínicos y parámetros bioquímicos al ingreso hospitalario.
ResultadosDel total de casos, 141 correspondían a pacientes con COVID grave y 40 pacientes con COVID leve. Los niveles de AAT1 se correlacionaron positivamente con los días de estancia, la gravedad, la proteína C reactiva, la ferritina, el ingreso en Cuidados Intensivos y el fallecimiento, y presentaron una correlación negativa con el número de linfocitos/mm3. Las concentraciones de AAT1 superiores a 237,5mg/dL permitieron catalogar al paciente como «grave» (S72%; E78%) y de 311,5mg/dL se asociaron con el riesgo de ingreso en Cuidados Intensivos o exitus (S67%; E79%).
ConclusionesLos niveles del producto de la expresión del gen SERPINA1, la AAT1, se correlacionan con la gravedad de los pacientes con COVID-19 al diagnóstico de la enfermedad, siendo útil como biomarcador pronóstico.
The SERPINA1 gene encodes the protein Alpha-1 Antitrypsin (AAT1). Possible imbalances between the concentrations of proteases and antiproteases (AAT1) can lead to the development of serious pulmonary and extrapulmonary pathologies. In this work we study the importance of this possible imbalance in patients with COVID-19.
ObjectivesTo correlate the severity of the symptoms of SARS-CoV-2 infection with the AAT1 concentrations at diagnosis of the disease.
MethodsAn observational, prospective, cross-sectional, non-interventional, analytical study was carried out where 181 cases with COVID-19 admitted to the “Lozano Blesa” University Clinical Hospital of Zaragoza were selected. The concentration of AAT1 was studied in all of them and this was correlated with the clinical aspects and biochemical parameters at hospital admission.
Results141 cases corresponded to patients with severe COVID and 40 patients with mild COVID. AAT1 levels were positively correlated with the days of hospitalization, severity, C-Reactive Protein, ferritin, admission to Intensive Care, and death, and presented a negative correlation with the number of lymphocytes/mm3. AAT1 concentrations higher than 237.5mg/dL allowed the patient to be classified as “severe” (S72%; E78%) and 311.5mg/dL were associated with the risk of admission to Intensive Care or Exitus (S67%;E79%).
ConclusionsLevels of the SERPINA1 gene expression product, AAT1, correlate with the severity of COVID-19 patients at diagnosis of the disease, being useful as a prognostic biomarker.
La enfermedad por coronavirus fue la causante de un alto número de muertes en los primeros meses de su aparición. Según cifras oficiales, la pandemia de COVID-19ha causado 120.715 muertes y el número de personas que han sido casos confirmados de COVID-19 en España es de 13.825.0521.
En la comunidad científica no hay un consenso acerca de la fisiopatología de esta enfermedad. En el momento actual, el modelo fisiopatológico más aceptado es el que distingue tres fases en función del tiempo de evolución de la enfermedad: fase 1 o de infección viral, fase 2 o de infección pulmonar, y fase 3 o de actividad inflamatoria. Aún después de declarada como acabada la pandemia se sigue estudiando la patología del SARS-CoV-2, ya que el citado modelo deja sin responder cuestiones importantes de la evolución de la enfermedad.
Desde un punto de vista fisiopatológico se sabe que2: 1) El SARS-CoV-2 es un virus RNA, 2) interacciona con el receptor ACE2 para poder introducirse dentro de la célula a la que infecta, 3) produce una importante activación de reactantes de fase aguda como la proteina C reactiva, la ferritina y la IL-6, y 4) ocasiona un grave estado protrombótico.
De lo anteriormente expuesto podemos deducir que una de las células diana implicadas en este modelo fisiopatológico es el macrófago, que se encuentra íntimamente relacionado no solo con la IL-6, sino con el metabolismo férrico3,4. Al día de hoy, esta enfermedad convive en la sociedad de una forma más controlada, a pesar de que el manejo y tratamiento de estos pacientes continúa siendo todo un reto, pues no existe un modelo fisiopatológico ni un buen biomarcador que prediga la evolución en los pacientes.
La alfa-1 antitripsina (AAT1) es una glucoproteína de fase aguda, hidrosoluble y difusible en tejidos. Tiene un peso molecular de 52-kDa y una vida media en sangre de unos cinco días5. En situación basal, el organismo produce 34mg/kg/día, actividad que se traduce por concentraciones plasmáticas de alrededor de 100-200mg/dL, siendo la antiproteinasa más abundante en suero6. La AAT1 está codificada por el gen SERPINA1, que se encuentra en el cromosoma 14q32.1 y comprende cuatro exones de codificación (II–V), tres exones no traducidos (Ia–Ic) y seis intrones7.
La síntesis de la AAT1 se lleva a cabo fundamentalmente en los hepatocitos (≈80%), y es una proteína multifactorial, con una importante propiedad inhibitoria de la serina proteasa en el suero humano. El sustrato específico de la AAT1 es la elastasa del neutrófilo (sinónimos: elastasa 2, ELA2), con la que reacciona con una constante de asociación de las más altas conocidas en fisiología. El mecanismo de acción de la AAT1 se basa en los aminoácidos metionina y serina, localizados en la zona móvil de la AAT1; estos forman enlaces covalentes con la elastasa neutrofílica, inhibiéndola y facilitando su fagocitosis por los macrófagos, para su posterior degradación en el hepatocito8–10. El sitio principal de actividad de la AAT1 está en el pulmón, protegiendo el frágil tejido conectivo de la parte inferior del tracto respiratorio de la proteólisis descontrolada provocada por los neutrófilos durante la inflamación11.
El gen de la AAT1 es activado fundamentalmente por productos generados en procesos inflamatorios. Los más conocidos son la endotoxina bacteriana o lipopolisacárido (LPS); el interferón-α; las citoquinas IL-1, IL-6 y TNF-α, así como diversos productos finales del estrés nitrooxidativo denominados genéricamente AGEs (Advanced Glycation End products). Al ser un reactante de fase aguda, en respuesta a estímulos inflamatorios o infecciosos se incrementan rápidamente sus niveles plasmáticos, entre 2-4 veces, acompañando a la proteína C reactiva (PCR) y al amiloide A, y este incremento se mantiene entre 7 y 15 días.
En la infección por SARS-CoV-2 está demostrada la hipoxia, la inflamación y la elevación de la PCR, la ferritina y la IL-6 en los pacientes graves. Debido a la íntima relación del macrófago y neutrófilo con la PCR y el metabolismo férrico, que se encuentran altamente alterados en los pacientes graves afectados por COVID-19, deducimos que la activación neutrofílica contribuye a la fisiopatología de esta entidad12. Por esta razón investigamos si la actividad de la AAT1 podría ser un marcador del proceso inflamatorio tan grave que acontece13. Surge por lo tanto la necesidad de investigar si el gen SERPINA1 y su expresión se encuentran alterados en esta grave entidad.
MétodosSe ha llevado a cabo un estudio observacional, prospectivo, transversal, no intervencionista con carácter analítico. Como objeto de este estudio se seleccionaron 181 casos con SARS-CoV-2 durante los meses de septiembre de 2020 a enero de 2021, todos ellos perfectamente caracterizados desde el punto de vista clínico, procedentes de los Servicios de Medicina Interna y Urgencias del Hospital Clínico Universitario «Lozano Blesa» de Zaragoza. Los criterios de inclusión en el estudio fueron los siguientes: 1) edad mayor a 18 años, 2) diagnóstico de infección por SARS-CoV-2 en el momento de la extracción de sangre usada como material para el estudio, 3) confirmación diagnóstica de la infección por SARS-CoV-2 mediante pruebas de reacción en cadena de la polimerasa y/o test de antígenos, 4) firma del consentimiento informado, y 5) estar de acuerdo con la realización y la finalidad del estudio.
El estudio fue aprobado por el Comité de Ética e Investigación de Aragón (CEICA) y se desarrolló acorde a los principios de la Declaración de Helsinki. Tras la firma del consentimiento informado se recopilaron una serie de parámetros clínicos, bioquímicos y genéticos de cada paciente en el momento de ingreso hospitalario y en los días sucesivos. Las variables recogidas fueron las siguientes: 1) edad, género, gravedad y número de días de estancia hospitalaria, 2) datos bioquímicos: ferritina, interleucina 6, linfocitos y proteína C reactiva al diagnóstico de la enfermedad o al ingreso hospitalario, en su caso, 3) score rale radiológico tórax (RxT SARS-CoV-2), 4) necesidad de ingreso en unidad de cuidados intensivos y exitus y, 5) concentración sérica de AAT1 al diagnóstico de la enfermedad o al ingreso hospitalario en su caso.
En este estudio hemos considerado pacientes con «COVID leve» a aquellos que acudieron al servicio de Urgencias, fueron diagnosticados y tratados y recibieron el alta a domicilio ese mismo día. Por otro lado, denominamos «COVID grave» a la enfermedad que padecieron aquellos pacientes que requirieron ingreso hospitalario y, dentro de estos, diferenciamos al «COVID crítico» que fue aquel que precisó ingreso en la Unidad de Cuidados Intensivos (UCI).
El análisis estadístico se llevó a cabo mediante el paquete estadístico SPSS-PC 29.0 realizando en primer término un estudio descriptivo y posteriormente analizando las diferentes variables entre sí considerando que existía una relación estadísticamente significativa con un valor de p<0,05.
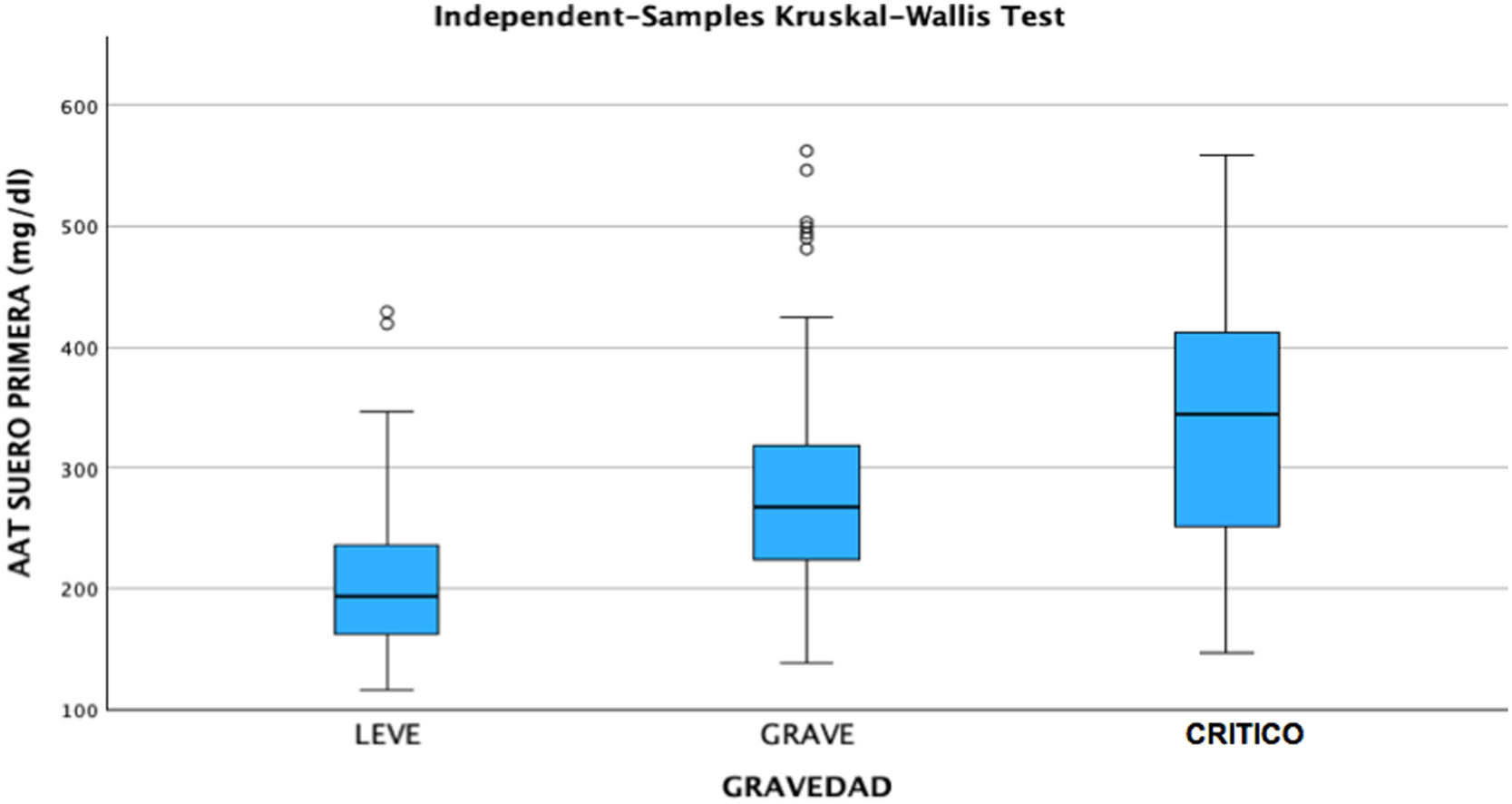
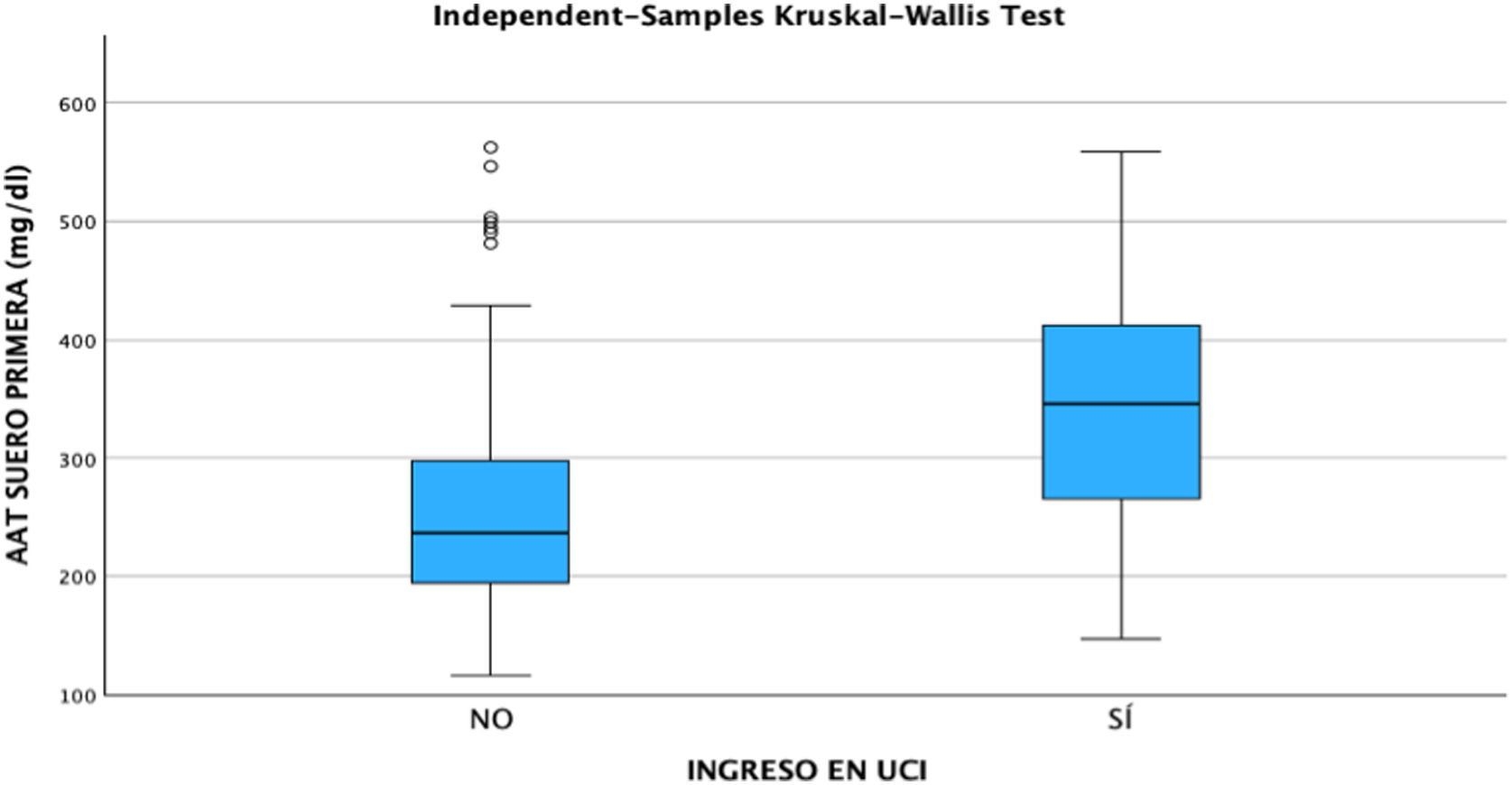
ResultadosDe los 181 pacientes que fueron seleccionados con base en los criterios anteriormente descritos, 141 casos correspondían a pacientes con COVID grave y 40 pacientes con COVID leve. Tras la clasificación de los pacientes en función de su gravedad, se observó que de los casos con COVID leve, el 50% fueron hombres y 50% mujeres. El COVID grave tuvo una mayor prevalencia en hombres, suponiendo un 60,28% del total de casos analizados. De los pacientes ingresados un 41,13% requirieron atención en la UCI, de los cuales el 67,24% fueron hombres y 32,76% mujeres. La media de las concentraciones séricas de AAT1 fue de 286,31mg/dL (291,37mg/dL en varones y 297,99mg/dL en mujeres). Los pacientes con ingreso en planta convencional tuvieron unas concentraciones medias de 270,76mg/dL y los que ingresaron en UCI 359,92mg/dL.
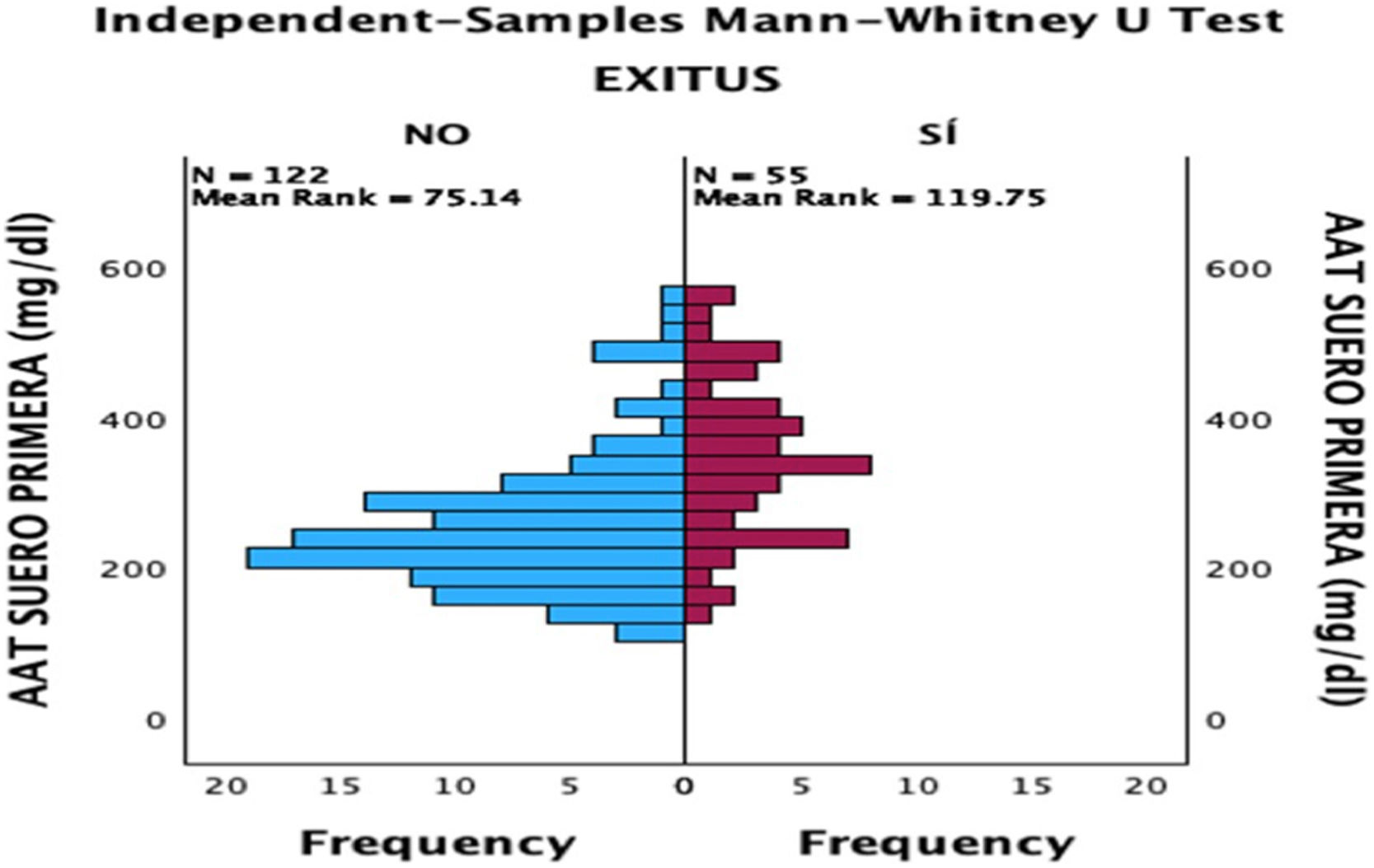
La mortalidad en los pacientes con COVID grave fue del 26,42%; siendo hombres el 64,86% y mujeres el 35,14% (fig. 1).
Tras la realización del análisis de regresión lineal entre las distintas variables cuantitativas, solamente se encontró una correlación moderada (r=0,49, p<0,05) entre las concentraciones de AAT1 al ingreso y los días de estancia, siendo el resto de correlaciones débiles o muy débiles (p<0,05). Posteriormente se llevó a cabo el análisis mediante el test Chi-cuadrado de la relación entre las variables cualitativas, siendo estadísticamente significativa (p<0,05) la correlación entre la gravedad del paciente (haciendo relación al paciente que precisa ingreso hospitalario), el ingreso en UCI (siendo por definición el paciente «crítico») y el posible fallecimiento del paciente. Ninguna de estas variables tuvo relación con el sexo del paciente. A continuación, se analizó la correlación entre los distintos biomarcadores y la gravedad de cada paciente, el sexo y el riesgo de ingreso en UCI o de fallecer. Se encontraron relaciones estadísticamente significativas entre las concentraciones al ingreso hospitalario de AAT1 con el número de linfocitos (en este caso la correlación fue negativa), los valores de proteína C reactiva y ferritina, y la gravedad, ingreso en UCI, o fallecimiento del paciente. La IL-6 no tuvo correlación con ninguna de las anteriores variables cualitativas comentadas (figs. 2, 3 y 4).
En ninguno de los análisis realizados se encontró correlación entre las variables analizadas y el sexo de cada paciente. Tampoco se encontró una correlación clara de los biomarcadores con el score radiológico.
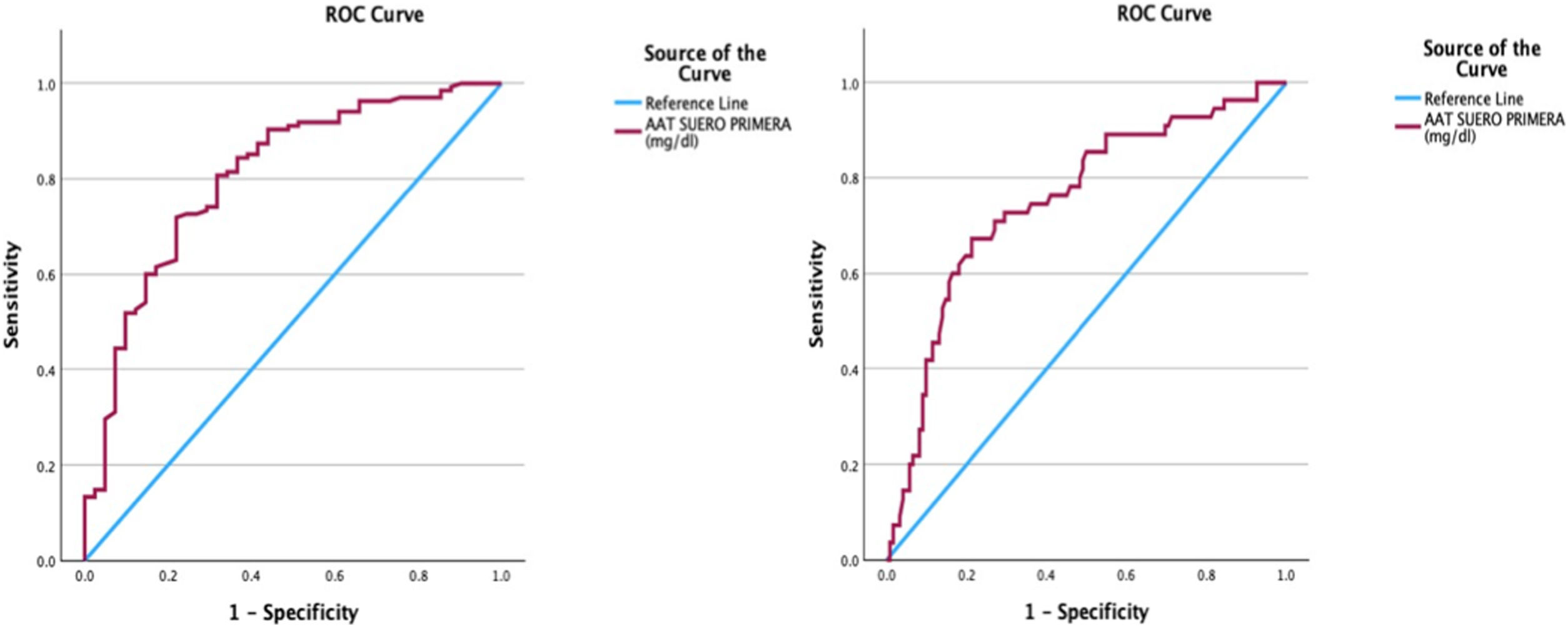
Posteriormente se realizó un análisis de la AAT1 mediante curva ROC como prueba con valor pronóstico al ingreso hospitalario en relación con la gravedad del paciente, el riesgo de ingreso en UCI y el riesgo de fallecer, obteniendo los siguientes resultados en forma de gráficas y de punto de corte para cada uno de los eventos o gravedad (fig. 5).
- •
De esta manera el área bajo la curva relacionando la concentración de AAT1 al ingreso con la gravedad del paciente fue de 0,806 (IC 95% 0,73-0,88), obteniendo un punto de corte para la AAT1 en lo concerniente al concepto «paciente grave» de 237,5mg/dL, con una S del 71.9% y una E del 78%.
- •
En lo concerniente a la curva ROC obtenida relacionando la actividad de AAT1 al ingreso hospitalario y riesgo de admisión en UCI o exitus, el área bajo la curva fue de 0,75 (IC 95% 0,67-0,83), obteniendo un punto de corte para la AAT1 de 311,5mg/dL, con una S del 67,3% y una E del 78,7%.
Nuestro estudio ha concluido con la identificación de un gen cuya expresión está íntimamente implicada en la fisiopatología de la disfunción orgánica que acontece en pacientes con infección grave por SARS-CoV-2. El estudio de la expresión del gen SERPINA1 en nuestra cohorte ha aportado gran cantidad de información que no han generado otras moléculas como la IL-6, la cual es una de las más estudiadas en esta entidad14. El gen SERPINA1 se encuentra muy activado en este síndrome y el estudio del producto de su expresión es sencillo, rápido, barato y reproductible.
En COVID-19, tanto los factores genéticos como los ambientales pueden estar involucrados en la comorbilidad15. Las predisposiciones genéticas descritas en genes como el ACE1 o el SERPINA1 pueden estar relacionados con esta entidad y, curiosamente, los polimorfismos en estos genes muestran frecuencias que difieren significativamente entre occidentales y asiáticos orientales16, pudiendo contribuir a las disparidades geográficas encontradas en lo concerniente a la gravedad y mortalidad de la infección por el virus SARS-CoV-217. Por todo ello, queremos destacar que los resultados obtenidos en nuestro medio proporcionan datos muy importantes para el conocimiento de la biopatología de la COVID- 19 y constituyen la base para el desarrollo de próximas líneas de investigación.
Al día de hoy pocos trabajos17,18 se han llevado a cabo en la población COVID-19 que comprometan al gen SERPINA1, pero estos han implicado a la AAT1 en 1) la inhibición de la IL-1B (que induce daño pulmonar mediante el estímulo de la producción de IL-6 y TNF-α); 2) antagonizar las complicaciones trombóticas condicionadas por el aumento de la trombina y plasmina; 3) inhibir las concentraciones de IL-6; 4) inhibir la IL-8 (íntimamente relacionada con la activación neutrofílica y el daño pulmonar agudo); 5) inactivar la proteasa trasmembrana serina 2 de los receptores de la célula huésped (TMPRSS2); 6) limitar la captación de partícula víricas de SARS-CoV-2; 7) favorecer la diferenciación de los linfocitos T y los macrófagos activados M2; 8) proteger de la activación de la vía de las caspasas 3 (y por lo tanto del estrés oxidativo); 9) suprimir la producción de TGF-B (íntimamente relacionado con la fibrosis irreversible), y 10) reducir la producción de radicales superóxido liberados por los neutrófilos activados, así como la migración neutrofílica. Es por ello que nuestros resultados son realmente relevantes ya que implican a la AAT1 con la gravedad y el fenotipo de los pacientes, de tal forma que a mayor AAT1, peor pronóstico y mayor probabilidad de ingreso en UCI o morir.
Sin embargo, metodológicamente hemos de mencionar limitaciones, ya que no hemos estudiado el genotipo del gen SERPINA1 y no se han clasificado los pacientes según determinados factores de riesgo que influyen no sólo en la fase aguda de la enfermedad, sino en la situación funcional respiratoria y calidad de vida residuales una vez superada la fase aguda19. Por otro lado, y dado que las concentraciones de IL-6 no correlacionaron con ninguna de las variables estudiadas al ingreso hospitalario, tampoco hemos tenido en cuenta el ratio AAT1/IL-6, cuyo valor incrementado protege a los pacientes COVID-19 del desarrollo de enfermedad grave y de trombosis, tal y como demostraron Philippe et al.20. Comparando este trabajo francés con el nuestro, encontramos diferencias significativas en los puntos de corte para pacientes graves (157mg/dL) y pacientes críticos (230mg/dL), siendo nuestros valores sensiblemente más elevados 237,5 y 311,5mg/dL, respectivamente.
Desafortunadamente, el estudio del gen SERPINA1 en la COVID-19 no resuelve el problema de la correlación genotipo/fenotipo. Sin embargo, sí nos ha permitido clasificar al conjunto de pacientes en «fenotipos imprevistos, graves o críticos» con las implicaciones prácticas desde el punto de vista asistencial que esto ha conllevado.
Por último, hemos de mencionar que, a partir de nuestro estudio, y en apoyo a la bibliografía previa, cabe la posibilidad de encontrarnos ante una futura diana terapéutica en los pacientes con COVID-19 grave o crítico: la administración exógena de AAT121,22.
ConclusionesLos pacientes con COVID-19 grave presentan elevaciones de AAT1 respecto a las concentraciones plasmáticas basales conocidas en la población sana.
El estudio de la concentración de AAT1 se ha mostrado útil como biomarcador pronóstico en pacientes graves afectados por SARS-CoV-2.
El fenotipo de los pacientes con SARS-CoV-2 se correlaciona con las concentraciones de AAT1 detectadas.
FinanciaciónEl presente estudio ha recibido fondos para su financiación procedentes del Instituto de Investigación Sanitaria de Aragón.
Conflicto de interesesTodos los autores del presente estudio declaran la ausencia de conflicto de intereses.